Matricea extracelulară
- Detalii
- Categorie: Biologie celulară
- Accesări: 16,479
Matricea extracelulară este constituită dintr-o reţea de macromolecule bioactive, ce intervin în numeroase procese de integrare cum ar fi: în adezivitatea şi comunicarea intercelulară, în controlul creşterii, diferenţierii şi al homeostaziei celulare, în migrarea celulară din embriogeneză, în fagocitoză, în repararea tisulară ş.a.
Matricea extracelulară este localizată între celule şi capilarele sanguine, astfel că ea devine adevăratul mediu intern al organismelor.
Prin intermediul glicocalixului, matricea extracelulară se află în relaţie de continuitate cu plasmalema tuturor celulelor. În felul acesta, compoziţia matricei extracelulare este controlată de către numeroasele celule cu care vine în contact, şi la rândul ei, poate influenţa o multitudine de funcţii celulare.
Spaţiile intercelulare, ocupate de matricea extracelulară, pot fi sistematizate în mai multe compartimente, în funcţie de organul în care se află: compartimentul osteo-cartilaginos, muscular, hepatic, pulmonar ş.a. In aceste compartimente, matricea extracelulară prezintă particularităţi de compoziţie chimică şi de structură bine definite. Toate compartimentele matricei extracelulare din organism sunt inter-comunicante.
Cel mai extins compartiment este cel din diferitele varietăţi de ţesuturi conjunctive. Aici, poartă denumirea de substanţă fundamentală conjunctivă şi, pe lângă funcţiile ei generale, are şi rolul de a conferi acestor ţesuturi elasticitatea sau rezistenţa mecanică specifică.
Structura moleculară a matricei extracelulare
Matricea extracelulară este alcătuită dintr-un gel hidratat, numit matrice fundamentală sau substanţă fundamentală, în care principalele molecule sunt cele de glicozaminoglicani şi de proteoglicani.
In matricea fundamentală sunt înglobate două categorii de proteine fibrilare şi anume:
- proteinele structurale - colagenul şi elastina
- proteinele de adeziune - fibronectina şi laminina
Atât matricea extracelulară cât şi proteinele fibrilare sunt produşi de secreţie ale câtorva tipuri de celule conjunctive, musculare şi epiteliale.
In anumite zone de contact dintre epitelii şi ţesutul conjunctiv se constituie o structură specială a matricei extracelulare, numită membrană bazală.
Matricea fundamentală
Matricea fundamentală, la microscopul optic, apare amorfă, iar datorită prezenţei proteoglicanilor are o afinitate specială faţă de coloranţii cationici (albastru alcian, fier coloidal), produce metacromazie în coloraţia cu albastru de toluidină şi este PAS-negativă.
Principalii constituenţi ai matricei fundamentale sunt: glicozamino- glicanii şi proteoglicanii.
Glicozaminoglicanii
Glicozaminoglicanii au fost denumiţi mucopolizaharide acide, sunt macromolecule poliglucidice liniare, neramificate, formate prin polimerizarea unui diglucid. Unul din componenţii diglucidului este, întotdeauna, un aminoglucid (N-acetilglucozamina sau N-acetilgalactozamina), iar celălalt component poate fi acidul glucuronic sau iduronic.
Principalii glicozaminoglicani sunt: condroitin-sulfaţii, dermatan- sulfatul, keratan-sulfatul, heparan-sulfatul, heparina şi acidul hialuronic.
În afară de acidul hialuronic, toţi ceilalţi glicozaminoglicani sunt sulfataţi (conţin radicalul SO42-), au molecula relativ scurtă şi se pot lega covalent de o proteină formând proteoglicanii.
Cantitativ, glicozaminoglicanii reprezintă doar 10% din masa matricei fundamentale, dar datorită conformaţiei lor moleculare foarte încolăcite (random coil) ajung să umple cea mai mare parte din spaţiul interstiţial intercelular.
Proteoglicanii
O macromoleculă izolată (monomer) de proteoglican este formată dintr- unlanţ sau miez polipeptidic, de care se ataşează lanţuri laterale de glicozaminoglicani, dintre care mai frecvent apar keratan-sulfatul şi condroitin-sulfatul. Molecula astfel asamblată, seamănă cu o perie de spălat eprubete, poate să atingă o greutate moleculară de 1,5-2,5 milioane Da.
În matricea extracelulară, proteoglicanii se pot asocia între ei sau se pot ataşa de alte molecule ca fibronectina, colagenul, elastina, dar mai ales de acidul hialuronic. Proteoglicanii mai bine cunoscuţi sunt cei din cartilagiile articulare, agrecanul, decorinul, biglicanul şi fibromodulina.
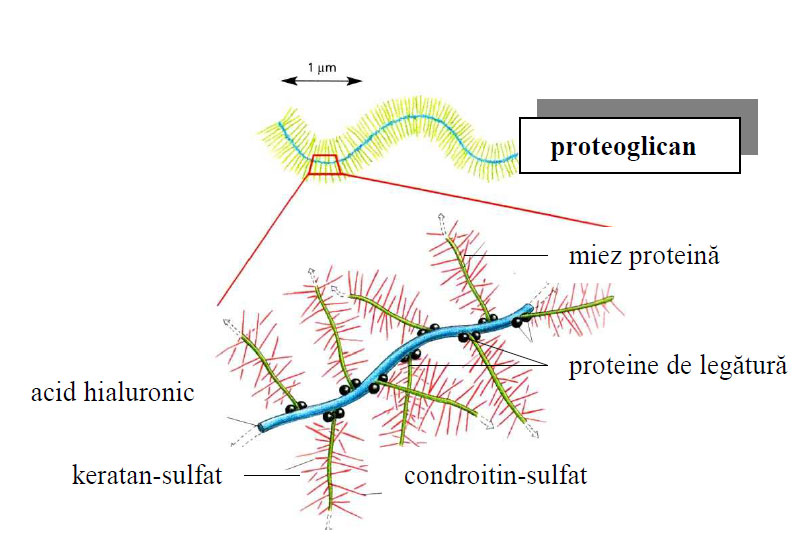
Figura 81 - Agregarea unei macromolecule de proteoglicani (după Alberts et al., 2010)
Proteoglicanii diferă între ei prin greutatea moleculară, componenţa proteică, numărul şi tipul de glicozaminoglicani, prezenţa şi poziţia grupărilor hidroxil şi a celor sulfat. Aceste grupări acide, prezente în molecula majorităţii glicozaminoglicanilor, sunt încărcate electric negativ, drept pentru care moleculele de proteoglicani se comportă ca polianioni.
În consecinţă, proteoglicanii se vor combina electrovalent cu cationii, în primul rând cu Na+, iar prin aceasta proteoglicanii devin intens hidrofili, adică reţin o cantitate de apă ce depăşeşte de 2-3 ori masa lor. Prin această însuşire proteoglicanii şi glicozaminoglicanii constituie un gel puternic hidratat ce umple spaţiile interfibrilare ale matricei extracelulare şi asigură ţesuturilor şi organelor turgescenţa optimă.
Chiar dacă majoritatea apei astfel reţinută este „apă legată”, numeroase substanţe solubile cu molecule mici pot fi vehiculate prin diferitele compartimente ale matricei extracelulare.
Glicozaminoglicanii şi proteoglicanii contribuie în mod esenţial la creşterea vâscozităţii matricei extracelulare, influenţând permeabilitatea şi transportul osmotic prin matricea extracelulară, dar limitând propagarea bacteriilor şi a altor microorganisme patogene.
Proteoglicanii sunt prezenţi pe suprafaţa multor celule, miezul lor proteic fiind integrat în structura plasmalemei, în acest fel participând la realizarea aderenţelor de tip celulă-celulă sau celulă-matrice extracelulară.
Proteoglicanii sunt sintetizaţi de anumite celule cu origine mezoblastică, cum ar fi: fibroblast, condroblast, osteoblast, celule sinoviale, fibre musculare netede. Miezul proteic poate fi scindat de proteaze, iar glicozaminoglicanii ataşaţi sunt scindaţi de glicozidaze şi sulfataze, enzime produse de celulele conjunctive specifice (macrofage).
Indivizii cu deficit genetic în sinteza acestor seturi enzimatice prezintă o acumulare masivă de proteoglicani în diferite ţesuturi şi organe, fapt ce se traduce prin manifestări clinice numite mucopolizaharidoze.
Proteinele fibrilare ale matricei extracelulare
Proteinele structurale principale sunt colagenul şi elastina, ce conferă matricei extracelulare rezistenţă mecanică şi elasticitate.
Colagenul
Din punct de vedere structural, colagenul este o scleroproteină, iar sub aspect chimic este o glicoproteină. Cantitativ, colagenul reprezintă 25-30% din totalul proteinelor organismului.
Colagenul este prezent sub formă de fibre extracelulare şi sub formă de membrane bazale.
În ţesuturile conjunctive, fibrele de colagen, de grosimi variabile, pot avea o dispunere laxă, o dispunere densă (ţesutul tendinos, ţesutul fibros) sau pot fi mineralizate (ţesutul osos, dentină).
Ca aminoacizi markeri specifici sunt hidroxiprolina şi hidroxilizina. Pe lângă aminoacizi, molecula de colagen mai conţine, în proporţii variabile, componenţi glucidici, în principal galactoză şi glucozilgalactoză.
În spaţiile intercelulare, ocupate de matricea extracelulară, colagenul se află sub formă de fibrile subţiri, care la microscopul electronic prezintă o striaţie transversală caracteristică, numită structură periodică. Această particularitate structurală lipseşte doar în fibrilele de colagen din membranele bazale.
Teoretic, prin combinarea tipurilor genetice de lanţuri alpha ar putea să rezulte peste 100 de feluri diferite de molecule de colagen, dar au fost identificate şi caracterizate doar 11 tipuri de colagen, din care primele cinci sunt mai bine reprezentate în organismele animale.
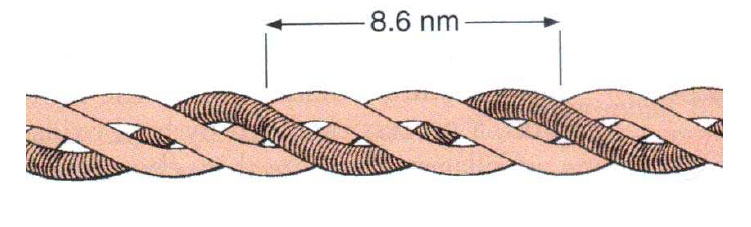
Figura 82 - Asamblarea moleculei de pro-colagen (după Mescher, 2010)
Colagenul interstitial (intercelular, extracelular) este de trei tipuri:
- colagenul tip I este predominant, prezent în oase, dinţi, tendoane, piele având fibrilele cu structură periodică se grupează în fibre şi fascicule. Este secretat de fribroblaste şi osteoblaste
- colagenul tip II formează fibrilele subţiri cu structură periodică din cartilajul hialin şi este secretat de condroplaste.
- colagenul tip III formează fibrile subţiri cu structură periodică, numite fibre de reticulină din majoritatea interstiţiilor organelor şi este secretat de fibroblastele pielii şi de fibrele musculare netede din pereţii organelor cavitare (artere, intestin, uter etc.).
Colagenul membranar şi pericelular prezintă fibrile omogene, fără structură periodică, ce se angrenează sub formă de reţea şi este de două tipuri:
- colagenul tip IV este caracteristic membranelor bazale şi este secretat de diferite celule epiteliale.
- colagenul tip V se află în aproape toate ţesuturile, unde formează reţele pericelulare, fiind secretat de fibrele musculare striate şi netede, de fibroblaste, de diferite celule epiteliale şi de către unele nevroglii.
Fibrilogeneza este procesul prin care molecula finită de colagen se asamblează în spaţiul extracelular, sub formă de structuri fibrilare. Fibrilele majorităţii tipurilor genetice de colagen prezintă la microscopul electronic striaţia transversală caracteristică (structura periodică), drept pentru care fibrilele formate sunt numite şi fibrile de tip nativ.
Structura periodică constă din repetarea aceleiaşi perioade de 670 Å ce conţineo zonă întunecată (electronodensă) mai lată şi o zonă clară (electrono- transparentă) puţin mai îngustă. Moleculele de colagen sunt dispuse în şiraguri paralele, între moleculele din acelaşi şir existând o distanţă (gap, hole) de 350 - 400 Å. Moleculele de colagen din şirurile paralele sunt decalate faţă de cele din şirul imediat învecinat cu o lungime de 270-320 Å (over-lapping). În fibrila
de colagen „nativ”, zonele întunecate corespund alinierii „în registru” a spaţiilor gap, iar zonele clare corespund alinierii identice a zonelor de decalare (over-lapping). Însumate, cele două zone măsoară 670 Å, adică exact lungimea unei perioade structurale.
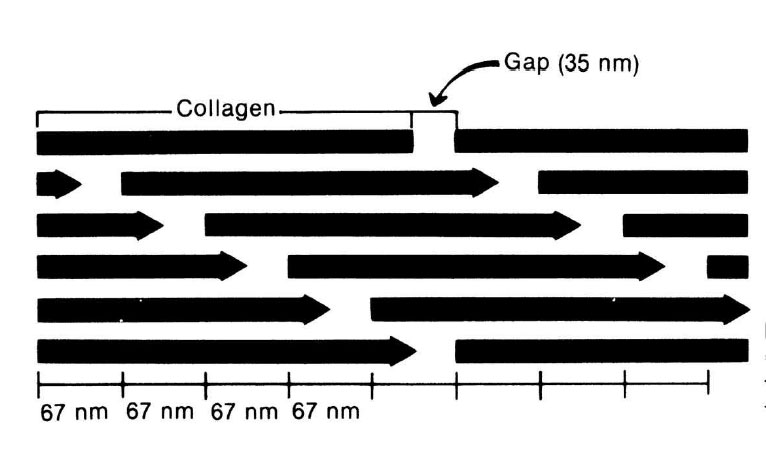
Figura 83 - Diagrama împachetării moleculelor polarizate de colagen din care rezultă structura periodică tipică (după Johnson, 1991)
La microscopul optic pe preparate uzuale, fibrele de colagen apar neanastomozate (nefuzionate), orientate pe direcţia forţelor mecanice ce acţionează asupra ţesutului respectiv.
Fibrele de colagen prezintă o afinitate faţă de coloranţii acizi (eozină, albastru de metil, verde luminos, fucsină acidă), iar histochimic sunt PAS- pozitive. Sub aspect mecanic, fibrele de colagen sunt greu extensibile şi deosebit de rezistente la rupere.
Unitatea structurală a tuturor varietăţilor de fibre colagene estemolecula de colagen, numită şi tropocolagen.
Procesul de biosinteză a colagenului cuprinde două etape importante:etapa intracelulară şi etapa extracelulară. Etapa extracelulară cuprinde două procese: convertirea moleculelor de pro-colagen în molecule de colagen şi fibrilogeneza (auto-agregarea moleculelor de colagen sub formă de fibrile).
În decursul creşterii organismului, în cadrul procesului de remodelare a structurilor conjunctive (al oaselor), în inflamaţii şi în vindecarea tisulară, colagenul (mai des cel interstiţial) poate fi degradat de o enzimă specifică, numită colagenaza animală, secretată de fibroblaste, macrofage, leucocite granulare, celule sinoviale şi celule epidermice.
Fibrele elastice
Spre deosebire de fibrele de colagen, fibrele elastice sunt foarte extensibile şi revin imediat la forma iniţială după ce încetează forţa care le-a deformat. Pe preparatele histologice uzuale, fibrele elastice sunt cromofobe. Ele pot fi evidenţiate doar cu coloranţi specifici cum ar fi orceina, rezorcină- fucsină Weigert şi paraldehid-fucsina.
Aspectul fibrelor elastice, adică grosimea, lungimea, modul lor de ramificare şi de anastomozare, diferă de la un organ la altul.
Biochimic, fibrele elastice sunt formate dintr-o proteină neglicozilată, hidrofobă, insolubilă, nedegradabilă prin fierbere, numită elastină.
La microscopul electronic, elastina apare formată dintr-un material fără aspect fibrilar, lipsit de structură periodică, amorf şi cu afinitate redusă faţă de coloranţii uzuali. La periferia miezului de elastină se observă microfibrile cu diametru de circa 110 Å, formate dintr-o proteină numită fibrilină.
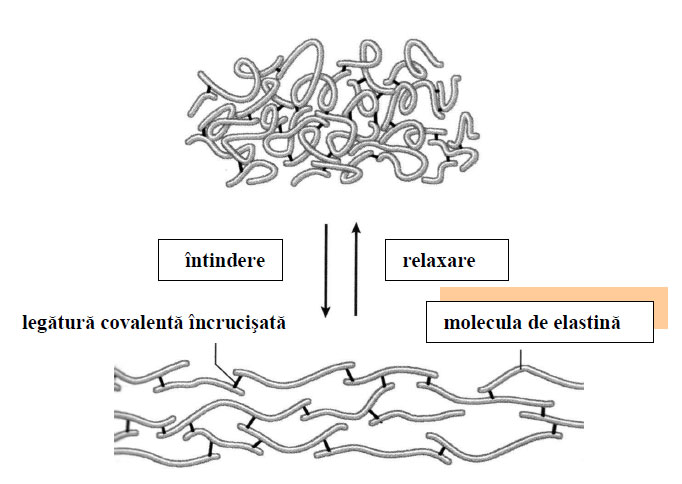
Figura 84 - Aspectul fibrelor elastice la întindere şi relaxare (după Mescher, 2010)
Elastina este secretată de fibroblaste şi de fibrele musculare netede, sub formă de macromolecule de tropo-elastină, care în spaţiul extracelular se asamblează sub formă de fibre. Degradarea specifică a fibrelor elastice este posibilă doar sub acţiunea enzimei numită elastază, secretată de pancreas.
În cursul unor boli, cum ar fi ateroscleroza, fibrele elastice se subţiază, se fragmentează, iar pe suprafaţa lor se pot depune calciu şi lipide.
Odată cu vârsta, sinteza de elastină încetează, iar fibrele existente suferă o elastoliză sub acţiunea elastazelor lizozomiale, produse de leucocitele neutrofile şi de macrofage. Fenomenul este mai evident la nivelul pulmonilor (emfizemulpulmonar) şi al pielii (ridarea).
Proteinele de adeziune ale matricei extracelulare
Principalele reprezentante ale acestei clase de proteine fibrilare ale matricei extracelulare sunt: fibronectina şi laminina.
Fibronectina
Este o glicoproteină cu rol în adeziunea dintre plasmalemă şi matricea extracelulară. Ea mai intervine în menţinerea formei celulare, în organizarea citoscheletului, precum şi în procesul de migrare şi de diferenţiere celulară.
În organism, fibronectina se află în sânge (ca dimeri solubili), ataşată la membrana celulelor (ca oligomeri) şi în matricea extracelulară (ca polimeri fibrilari insolubili). Fibronectina este sintetizată de fibroblaste şi de alte celule de natură conjunctivă, dar şi de endotelii şi epitelii. Pe traiectul moleculei fibrilare, există regiuni specifice pentru ataşarea de plasmalemă sau de reţeaua de colagen, fibrină şi de proteoglicanii din matricea extracelulară.
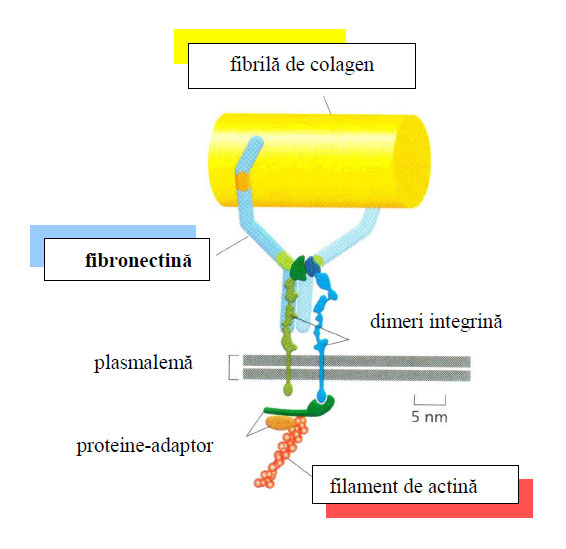
Figura 85 - Fibronectina şi moleculele de integrină ataşează celula la matricea extracelulară
(după Alberts et al., 2010)
Recunoaşterea şi ataşarea fibronectinei la suprafaţa celulară este făcută de receptori specifici, numiţi integrine. Această integrină pentru fibronectină recunoaşte şi ataşează fibronectina fibrilară prin capătul ei extracelular, iar prin cel intracelular se leagă de filamentele de actină ale citoscheletului. Astfel de integrine există şi pentru colagen şi pentru laminină.
Laminina
Este o glicoproteină constitutivă a membranelor bazale cu rol de a media aderenţa dintre suprafaţa celulară şi membrana bazală. Laminina are molecula formată din trei lanţuri polipeptidice în formă de cruce şi unite prin punţi disulfidice. Laminina conţine oligoglucide în proporţie de 12-15%.
Pe traiectul braţelor sale, macromolecula de laminină prezintă mai multeporţiuni globulare, ce reprezintă tot atâtea domenii funcţionale, prin care laminina se ataşează de receptorii membranari specifici (integrine), precum şi de colagenul tip IV din membranele bazale, de heparină şi de heparan-sulfat din matricea extracelulară.
Alte proteine care participă la organizarea matricei extracelulare sunt: entactina, nidogenul, trombospondina, vitronectina, condronectina, lectinele membranare, lectinele solubile şi tenascina.
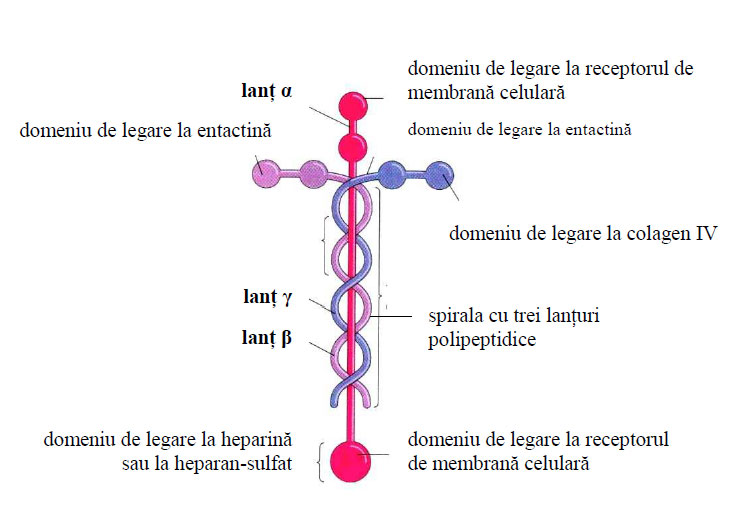
Figura 86 - Structura lamininei
Membrana bazală
Membrana bazală este o structură specializată a matricei extracelulare, situată la baza diferitelor epitelii, pe care le separă de ţesutul conjunctiv subiacent. Uneori, membrana bazală înconjoară complet celulele (adipocitele, fibrele musculare, celulele Schwann) sau se interpune între două epitelii (în cazul glomerulilor renali şi a alveolelor pulmonare). Membrana bazală este elaborată, în cooperare, de către celulele epiteliale şi celulele conjunctive din vecinătate.
La microscopul optic membrana bazală se observă cu dificultate fiind foarte subţire, în general de sub 1 p,m. Evidenţierea ei este mai bună dacă se practică reacţia PAS (pentru evidenţierea componentei poliglucidice) sau prin impregnare argentică (pentru evidenţierea reţelei de fibre de reticulină).
La microscopul electronic membrana bazală apare formată din trei straturi:
- lamina lucida (lamina clara), care este un strat electronotransparent, amorf, gros de circa 100 Å, situat în imediata vecinătate a polului bazal al celulelor epiteliale; ataşarea celulelor epiteliale la lamina lucida se face prin hemidesmozomi;
- lamina densa este un strat electronodens, gros de 200-300 Å, alcătuit dintr-o matrice amorfă, densă, în care sunt incluse numeroase filamentele subţiri;
- lamina reticularis (lamina fibroreticularis) este un strat mai puţin conturat, alcătuit dintr-o reţea de colagen fibrilar, ce se continuă, fără o demarcare netă, cu ţesutul conjunctiv alăturat.
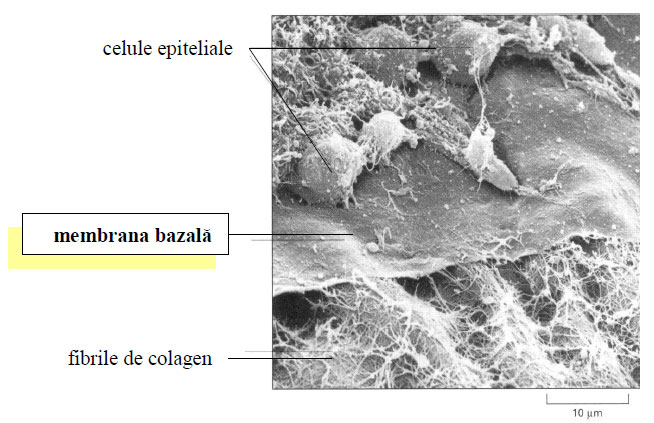
Figura 87 - Membrana bazală, cornee embrion de pui, SEM 50.000x (după Alberts et al., 2010)
Compoziţia şi structura membranei bazale variază destul de mult de la un organ la altul, totuşi, în toate aspectele găsim ca elementele comune: colagenul tip IV, proteoglicanii, laminina, entactina, nidogenul şi fibronectina.
O menţiune suplimentară necesită colagenul tip IV, esenţial diferit faţă de alte tipuri de colagen, deoarece molecula sa este mai lungă, îşi păstrează capetele pro-peptidice, iar acest fapt împiedică auto-agregarea sub formă de fibrile şi fibre cu structură periodică.
Laminina este localizată în partea dinspre epiteliu a laminei densa, filamentele ei ataşându-se de receptorii celulelor epiteliale, de colagen şi de proteoglicani.
Proteoglicanul heparan-sulfat este component universal al membranei bazale, localizat atât în lamina reticularis, cât şi în lamina densa, intervenind în permeabilitatea selectivă a membranei bazale.
Funcţiile membranei bazale
Membrana bazală determină şi stabilizează arhitectura epiteliilor, menţinând starea lor de diferenţiere.
Membrana bazală induce polarizarea celulelor epiteliale şi organizarea citoscheletului acestora.
Membrana bazală intervine în permeabilitatea selectivă a diferitelor bariere (cutanată, intestinală, renală, respiratorie, placentară ş.a.).
Membrana bazală serveşte ca substrat al deplasărilor celulare, atât în cursul embriogenezei, cât şi la individul adult (deplasarea enterocitelor, a keratinocitelor). Membrana bazală serveşte ca substrat în regenerarea reparatorie a epiteliilor.
În cazul tumorilor, membrana bazală este prezentă la periferia celor benigne, adică conturează tumoarea benignă, nepermiţându-i să prolifereze anarhic, dar este discontinuă, perforată în cazul tumorilor maligne, fapt ce precede metastazarea. Colagenul tip IV din membranele bazale nu este degradat de colagenaza animală, ci doar de către colagenaza bacteriană. În cazul tumorilor maligne, acestea elaborează o colagenază foarte activă, ce poate distruge membrana bazală.