ARN - Acidul Ribonucleic
- Detalii
- Categorie: Biochimie
- Accesări: 1,660
Acidul ribonucleic, cunoscut sub abrevierea ARN (sau RNA în limba engleză - Ribonucleic Acid), reprezintă una dintre cele mai fascinante și fundamentale molecule biologice din toate formele de viață cunoscute. În timp ce ADN-ul (acidul dezoxiribonucleic) este adesea descris ca "planul genetic" al unui organism, ARN-ul joacă rolul de mesager și executor al informațiilor genetice, fiind esențial în procesele de transcriere și traducere a codului genetic. În ultimele decenii, cercetările științifice au dezvăluit complexitatea uimitoare și diversitatea funcțională a acestei molecule, extinzând dramatic înțelegerea noastră despre rolurile sale în biologia celulară și moleculară.
ARN-ul nu mai este privit doar ca un simplu intermediar între ADN și proteine, ci ca un actor principal în reglarea expresiei genice, în cataliză și în multe alte procese biologice esențiale. Descoperirile recente în domeniul ARN-ului non-codant, al structurilor complexe de ARN și al tehnologiilor bazate pe ARN au revoluționat biologia moleculară și au deschis noi perspective pentru aplicații biomedicale, de la terapii genice până la vaccinuri și diagnostice moleculare.
Acest articol își propune să exploreze în profunzime lumea acidului ribonucleic, de la structura sa chimică fundamentală, la diversele sale tipuri și funcții biologice, continuând cu aplicațiile sale în medicina modernă și tehnologiile emergente. Vom examina, de asemenea, modul în care studiul ARN-ului a modificat radical înțelegerea noastră asupra evoluției vieții și asupra mecanismelor celulare fundamentale.
Structura chimică și proprietățile ARN-ului
Compoziție și structură primară
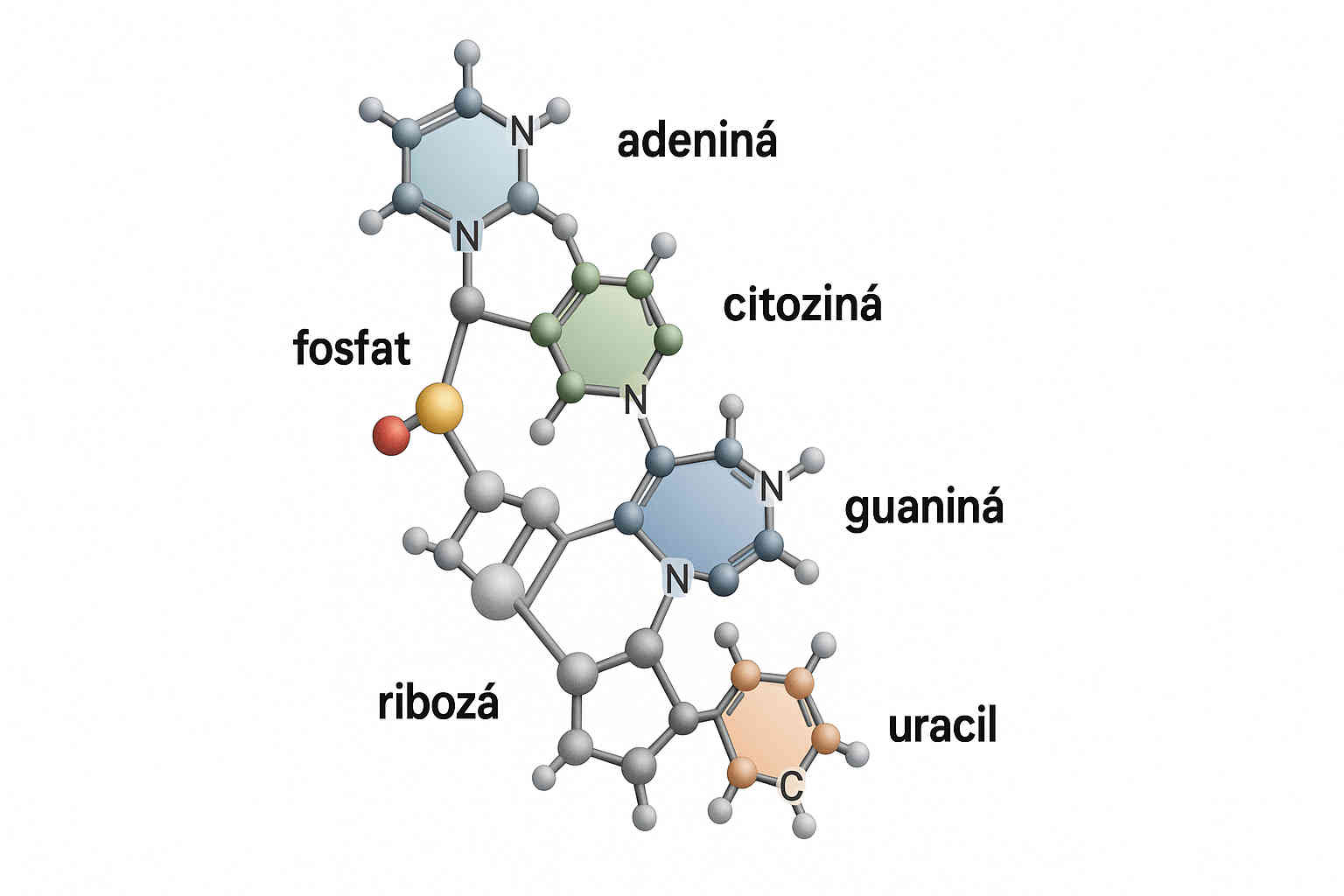
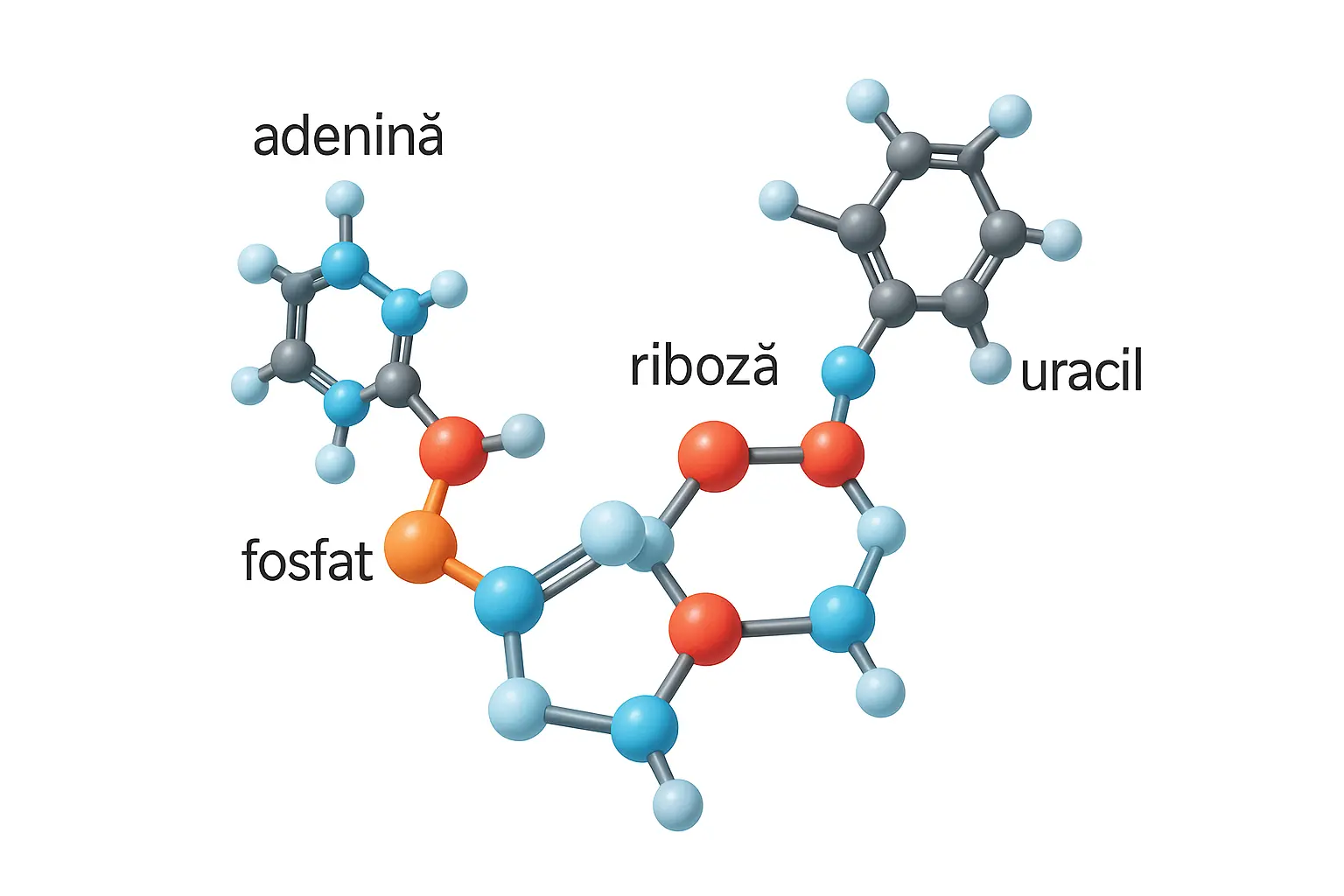
Acidul ribonucleic este un polimer alcătuit din unități repetitive numite nucleotide. Fiecare nucleotidă constă din trei componente esențiale:
- O bază azotată - una dintre cele patru baze: adenină (A), guanină (G), citozină (C) sau uracil (U)
- O moleculă de zahar pentoză - riboză
- O grupare fosfat
Diferența fundamentală față de ADN constă în prezența ribozei în locul dezoxiribozei (de unde și numele de acid ribonucleic) și înlocuirea bazei timină (T) cu uracil (U). Riboza conține un grup hidroxil (OH) suplimentar la poziția 2' a inelului de zahar, care conferă ARN-ului proprietăți chimice distincte și o stabilitate mai redusă comparativ cu ADN-ul.
Structura secundară și terțiară
Spre deosebire de ADN, care există predominant ca un dublu helix, ARN-ul este în general monocatenar, dar această caracteristică îi permite să formeze structuri secundare complexe prin împerechere intramoleculară a bazelor. Regiunile complementare se pot împerechea (A cu U, G cu C), formând structuri cum ar fi:
- Tije (stem) - regiuni cu baze împerecheate perfect
- Bucle (loops) - regiuni neîmperecheate
- Bulging-uri - regiuni cu nucleotide nepereche care "ies" din structură
- Joncțiuni - puncte de intersecție între diferite elemente structurale
- Pseudonoduri - structuri în care buclele formează împerecheri cu regiuni distante
Aceste structuri secundare pot conduce la formarea unor structuri terțiare complexe care sunt esențiale pentru funcția biologică a ARN-ului, în special pentru ARN-urile cu rol catalitic sau reglator.
Proprietăți fizico-chimice distinctive
| Proprietate | Caracteristici ale ARN-ului | Comparație cu ADN-ul |
|---|---|---|
| Stabilitate | Mai puțin stabil datorită grupului 2'-OH | Mai stabil în condiții fiziologice |
| Conformație | Predominant monocatenar, dar poate forma structuri complexe | Predominant dublu helix (structura B) |
| Hidroliză | Sensibil la hidroliză alcalină | Rezistent la hidroliză alcalină |
| Aciditate | pKa ≈ 3.5-4 pentru grupările fosfat | Similar |
| Solubilitate | Mai solubil în apă | Mai puțin solubil |
| Absorbție UV | Maximum de absorbție la ~260 nm | Similar |
| Densitate | ~2.0 g/cm³ | ~1.7 g/cm³ |
Aceste proprietăți fizico-chimice au consecințe importante pentru funcțiile biologice ale ARN-ului și pentru manipularea sa în laboratoare. De exemplu, sensibilitatea la hidroliză face ca ARN-ul să fie mai dificil de manipulat experimental, dar permite și o reglare mai rapidă a expresiei genice prin degradarea controlată a ARN mesager.
Clasificarea și tipurile principale de ARN

Diversitatea tipurilor de ARN reprezintă un aspect fundamental al complexității biologice. În funcție de rol și structură, ARN-urile pot fi clasificate în mai multe categorii principale:
ARN-uri implicate în sinteza proteică
ARN mesager (ARNm)
ARNm reprezintă transcriptul direct al genelor codante și servește ca șablon pentru sinteza proteinelor. Structura sa tipică include:
- O regiune 5' netradusă (5' UTR)
- Un cadru deschis de lectură (ORF) care conține secvența codantă
- O regiune 3' netradusă (3' UTR)
- O coadă poli-A la capătul 3'
- O structură cap (cap) la capătul 5' (în organismele eucariote)
ARNm eucariot suferă procese complexe de maturare, inclusiv eliminarea intronilor (splicing), adăugarea capului și a cozii poli-A, care sunt esențiale pentru stabilitatea, transportul și traducerea eficientă a acestuia.
ARN de transfer (ARNt)
ARNt are rolul crucial de a transporta aminoacizii la ribozom în timpul sintezei proteice. Structura sa distinctivă în formă de "trifoi" este foarte conservată evolutiv și include:
- Un braț acceptor care leagă aminoacidul specific
- Un anticodon care recunoaște codonul complementar din ARNm
- Bucle D, TΨC și variabilă care contribuie la structura terțiară
- Numeroase modificări post-transcripționale care afectează funcționalitatea
ARN ribozomal (ARNr)
ARNr formează componenta structurală și funcțională a ribozomilor, mașinăriile celulare responsabile pentru sinteza proteică. Ribozomii conțin mai multe tipuri de ARNr:
| Tip ARNr | Organism | Coeficient de sedimentare | Număr de nucleotide |
|---|---|---|---|
| ARNr 5S | Procariot & Eucariot | 5S | ~120 |
| ARNr 5.8S | Eucariot | 5.8S | ~160 |
| ARNr 16S | Procariot | 16S | ~1540 |
| ARNr 18S | Eucariot | 18S | ~1900 |
| ARNr 23S | Procariot | 23S | ~2900 |
| ARNr 28S | Eucariot | 28S | ~5000 |
ARNr nu doar că formează structura ribozomului, dar participă activ la procesul de sinteză proteică, având rol catalitic în formarea legăturilor peptidice.
ARN-uri non-codante cu rol reglator
ARN mic nuclear (ARNsn)
ARNsn funcționează în complexele spliceozomale, participând la procesarea ARNm prin eliminarea intronilor. Tipurile principale (U1, U2, U4, U5, U6) formează ribonucleoproteine care recunosc situsurile de splicing și catalizează reacțiile de îndepărtare a intronilor.
ARN mic nucleolar (ARNsno)
Aceste molecule dirijează modificările post-transcripționale ale ARNr, ARNt și unor ARNsn, inclusiv metilarea și pseudouridilarea. Există două clase principale: ARNsno cu cutii C/D (care ghidează metilarea 2'-O) și ARNsno cu cutii H/ACA (care ghidează pseudouridilarea).
MicroARN (miARN)
miARN-urile sunt scurte molecule de ARN (~22 nucleotide) implicate în reglarea expresiei genice post-transcripționale prin inhibarea traducerii și/sau degradarea ARNm țintă. Procesul include:
- Transcrierea pre-miARN
- Procesarea de către Drosha în nucleu
- Exportul în citoplasmă
- Procesarea finală de către Dicer
- Încorporarea în complexul RISC pentru țintirea ARNm specific
ARN interferent mic (siARN)
Similar cu miARN-urile, siARN-urile funcționează prin mecanismul de interferență ARN pentru reglarea expresiei genice, dar provin din ARN dublu-catenar lung și au un grad mai mare de complementaritate cu țintele lor.
ARN lung non-codant (ARNlnc)
ARNlnc sunt molecule de ARN mai lungi de 200 de nucleotide care nu codifică proteine dar joacă roluri importante în reglarea expresiei genice la multiple niveluri, inclusiv:
- Remodelarea cromatinei
- Reglarea transcripției
- Procesarea post-transcripțională
- Localizarea și stabilitatea ARNm
- Modificarea activității proteinelor
ARN circular (ARNcirc)
ARNcirc reprezintă o clasă unică de molecule de ARN formate prin îmbinarea capetelor 3' și 5', rezultând structuri circulare covalent închise. Aceste molecule sunt rezistente la degradarea de către exonucleaze și pot funcționa ca "spongiere" pentru miARN sau ca regulatori ai expresiei genice.
Funcții biologice fundamentale ale ARN-ului
Fluxul informației genetice: de la ADN la proteine
Dogma centrală a biologiei moleculare descrie fluxul informației genetice de la ADN la ARN și apoi la proteine. ARN-ul joacă roluri esențiale în acest proces:
- Transcripția: Informația genetică este copiată din ADN în ARNm de către ARN polimerază
- Procesarea post-transcripțională: ARNm precursor este modificat prin:
- Splicing (eliminarea intronilor și unirea exonilor)
- Adăugarea capului 5' (7-metilguanozină)
- Poliadenilarea la capătul 3'
- Editarea ARN (modificări ale bazelor)
- Exportul din nucleu: ARNm matur este transportat în citoplasmă
- Traducerea: ARNm este decodificat de către ribozomi (compuși din ARNr și proteine) cu ajutorul ARNt pentru a sintetiza proteine
Acest proces fundamental este esențial pentru expresia genelor și pentru toate funcțiile celulare derivate.
ARN-ul ca enzimă: ribozimele
Una dintre cele mai revoluționare descoperiri în biologia moleculară a fost identificarea capacității catalitice a ARN-ului. Ribozimele sunt molecule de ARN cu activitate catalitică similară enzimelor proteice. Câteva exemple importante includ:
| Ribozimu | Funcție | Descoperire |
|---|---|---|
| ARNr 23S | Catalizează formarea legăturilor peptidice în ribozom | Noller & Cech, 1992 |
| RNaza P | Procesează ARNt precursor | Altman & colab., 1983 |
| Intronii autoexcizabili Grup I | Catalizează propria lor excizare | Cech & colab., 1982 |
| Riboswitch-uri | Reglează expresia genică prin schimbări conformaționale | Breaker & colab., 2002 |
| Hammerhead ribozyme | Clivează ARN prin hidroliză | Forster & Symons, 1987 |
Descoperirea ribozimelor a oferit suport pentru ipoteza "lumii ARN" care sugerează că viața ar fi putut începe cu molecule de ARN autoreplicante înainte de apariția proteinelor și ADN-ului.

Rolul ARN-ului în reglarea expresiei genice
Reglarea genelor de către ARN se realizează prin mecanisme multiple și sofisticate:
- Controlul transcripțional: ARNlnc pot interacționa cu factori de transcripție sau cu complexe remodelante ale cromatinei pentru a activa sau reprima transcripția genelor
- Controlul post-transcripțional:
- miARN-urile reglează traducerea și stabilitatea ARNm
- siARN-urile direcționează degradarea specifică a ARNm
- ARNcirc pot funcționa ca "spongiere" pentru miARN
- ARNlnc pot modula procesarea ARNm, incluzând splicing-ul alternativ
- Controlul traducțional:
- Riboswitch-urile sunt elemente structurale din ARNm care își schimbă conformația când leagă metaboliți specifici, reglând astfel traducerea
- ARN antisens poate bloca traducerea prin împerecherea cu ARNm țintă
- Silențierea genică mediată de ARN: Complexele ARN-proteină pot induce modificări epigenetice care conduc la silențierea genelor pe termen lung
Aceste mecanisme de reglare bazate pe ARN permit un control fin al expresiei genice, esențial pentru dezvoltare, diferențiere celulară și răspunsul la stimuli de mediu.
Rolul ARN-ului în evoluție și originea vieții
Ipoteza lumii ARN
Ipoteza lumii ARN, propusă de Walter Gilbert în 1986, sugerează că viața ar fi putut începe cu molecule de ARN capabile atât să stocheze informație genetică, cât și să catalizeze reacții chimice. Această ipoteză oferă o soluție la paradoxul "ou-găină" referitor la ce a apărut mai întâi: ADN-ul sau proteinele.
Argumente în favoarea acestei ipoteze includ:
- ARN-ul poate stoca informație genetică ca și ADN-ul
- ARN-ul poate cataliza reacții chimice (ribozime)
- Nucleotidele ARN pot fi sintetizate în condiții prebiotice
- Coenzimele moderne (ATP, NAD, CoA) conțin nucleotide de ARN ca parte a structurii lor
- ARN-ul joacă încă roluri centrale în procese biochimice fundamentale precum traducerea
Fosile moleculare ale lumii ARN
Multe structuri și procese celulare contemporane păstrează urme ale unui trecut dominat de ARN:
| "Fosilă moleculară" | Descriere | Relevanță pentru lumea ARN |
|---|---|---|
| Ribozomul | Centrul peptidil-transferazei este format din ARNr | Sinteza proteică a fost inițial catalizată de ARN |
| Spliceozomul | Componentele ARN (snARN) catalizează splicing-ul | Procesarea ARN era inițial mediată de ARN |
| Coenzimelele cu bază nucleotidică | ATP, NAD+, CoA, etc. | Metabolismul timpuriu era probabil bazat pe ribonucleotide |
| ARNt | Structură foarte conservată | Legătura dintre codul genetic și aminoacizi |
| Intronii autoexcizabili | Sequențe de ARN care se autoclivează | Remanențe ale mecanismelor auto-procesante de ARN |
De la lumea ARN la lumea ADN-proteine
Se presupune că tranziția de la o lume dominată de ARN la lumea actuală ADN-proteine a urmat pași evolutivi graduali:
- ARN autoreplicant inițial cu funcții catalitice limitate
- Evoluția ribozimelor mai complexe capabile să catalizeze sinteza aminoacizilor și peptidelor simple
- Colaborarea ARN-peptide pentru funcții catalitice îmbunătățite
- Dezvoltarea sistemului primitiv de traducere bazat pe ARN
- Apariția sintezei ADN-ului ca moleculă mai stabilă pentru stocarea informației genetice
- Evoluția gradată a mașinăriei moderne de traducere și replicare
Această ipoteză a lumii ARN rămâne fundamentală pentru înțelegerea originii vieții și a evoluției sistemelor biologice timpurii.
ARN-ul în tehnologia modernă și aplicații biomedicale
Tehnologii bazate pe ARN pentru cercetare
ARN-ul a devenit un instrument indispensabil în cercetarea biologică modernă:
- Interferența ARN (RNAi): Utilizarea siARN pentru silențierea specifică a genelor a revoluționat studiul funcției genelor și a oferit o metodă puternică pentru validarea țintelor terapeutice
- CRISPR-Cas9: Deși Cas9 este o proteină, ghidarea sa la secvențe specifice de ADN se realizează prin ARN ghid, făcând această tehnologie de editare genomică dependentă de specificitatea ARN
- Aptamere de ARN: Molecule de ARN selecționate pentru a lega cu înaltă specificitate și afinitate diverse ținte moleculare, utilizate în cercetare, diagnostic și terapeutică
- Riboswitches sintetice: Elemente reglatoare bazate pe ARN care pot fi proiectate pentru a controla expresia genică în răspuns la stimuli specifici
- Single-cell RNA sequencing: Tehnologie care permite analiza expresiei genice la nivel de celulă individuală, revoluționând înțelegerea heterogenității celulare și a traiectoriilor de dezvoltare
Terapii bazate pe ARN
Ultimii ani au adus o adevărată revoluție în dezvoltarea terapiilor bazate pe ARN:
| Tip terapie | Mecanism | Exemple aprobate/în dezvoltare |
|---|---|---|
| siARN | Silențierea post-transcripțională a genelor | Patisiran (Onpattro) - amiloidoză TTR |
| Oligonucleotide antisens | Blocarea procesării sau traducerii ARNm | Nusinersen (Spinraza) - atrofie musculară spinală |
| Aptamere ARN | Legarea specifică de ținte moleculare | Pegaptanib (Macugen) - degenerescență maculară |
| mRNA terapeutic | Furnizarea de ARNm pentru exprimarea unei proteine terapeutice | Vaccinuri COVID-19 (Pfizer/BioNTech, Moderna) |
| Editarea ARN | Modificarea specifică a secvenței ARNm | Terapii pentru distrofia musculară Duchenne (în dezvoltare) |
| Ribozime terapeutice | Clivarea specifică a ARN țintă | Tratamente experimentale pentru HIV, hepatită C |
Vaccinurile ARNm împotriva COVID-19 reprezintă poate cel mai spectaculos succes recent al terapiilor bazate pe ARN, demonstrând potențialul acestei abordări pentru dezvoltarea rapidă și eficientă a imunoterapiilor.
Diagnosticul bazat pe ARN
ARN-ul oferă oportunități unice pentru diagnosticul molecular:
- Profilarea expresiei genice: Analizarea patternurilor de expresie a ARNm pentru diagnosticul și clasificarea bolilor, în special a cancerului
- Biomarkeri bazați pe ARN: miARN, ARNcirc și alte ARN non-codante circulante pot servi ca biomarkeri pentru diverse afecțiuni
- Tehnici diagnostice bazate pe amplificarea ARN: RT-PCR, NASBA și alte metode pentru detectarea agenților infecțioși
- Teste point-of-care bazate pe ARN: Tehnologii precum CRISPR-Dx utilizează detectarea ARN pentru diagnosticul rapid și precis la punctul de îngrijire
- Tehnici bazate pe secvențierea ARN: RNA-seq și alte metode de secvențiere de nouă generație pentru caracterizarea transcriptomului în scop diagnostic
Provocări și perspective în cercetarea ARN
Provocări tehnice în manipularea și studiul ARN-ului
Natura chimică și biologică a ARN-ului ridică provocări specifice pentru cercetători:
- Instabilitatea: Gruparea 2'-OH face ARN-ul susceptibil la hidroliză, necesitând tehnici speciale pentru manipulare
- Contaminarea cu RNaze: Enzimele care degradează ARN sunt abundente și foarte stabile, necesitând precauții stricte
- Compexitatea structurală: Structurile secundare și terțiare complică analiza și manipularea ARN
- Modificările post-transcripționale: Peste 170 de modificări chimice diferite ale ARN complică analiza precisă a acestuia
- Heterogenitatea: Diverse forme de ARN și variante de splicing cresc complexitatea analizei
Frontiere emergente în biologia ARN
Câteva direcții de cercetare promițătoare în domeniul ARN includ:
- Epitranscriptomica: Studiul modificărilor chimice ale ARN și rolul lor în reglarea expresiei genice
- ARN și organizarea tridimensională a nucleului: Înțelegerea rolului ARNlnc în organizarea spațială a genomului
- Rolul ARN în comunicarea intercelulară: Studiul exozomilor și al altor vezicule extracelulare care transportă ARN între celule
- Localizarea subcellulară a ARN: Mecanismele și importanța localizării specifice a ARN în diferite compartimente celulare
- Dezvoltarea de noi tehnologii pentru manipularea și vizualizarea ARN in vivo: Metode pentru urmărirea ARN în celule vii cu rezoluție spațială și temporală înaltă
Perspective pentru aplicații biomedicale viitoare
Potențialele aplicații ale tehnologiilor bazate pe ARN în viitorul apropiat includ:
- Vaccinuri ARNm personalizate: Dezvoltarea de vaccinuri personalizate împotriva cancerului bazate pe neoantigeni specifici tumorilor
- Terapii de editare a ARN: Alternative la editarea genomică cu potențial redus de efecte off-target
- Nanomașini bazate pe ARN: Structuri artificiale de ARN programate pentru funcții specifice în diagnostic și terapie
- Reglarea expresiei genice cu precizie ridicată: Tehnologii pentru controlul spațio-temporal al expresiei genelor
- Tratamente pentru boli genetice rare: Abordări personalizate pentru corectarea defectelor genetice la nivel de ARN
Întrebări frecvente despre Acidul Ribonucleic (ARN)
1. Ce este acidul ribonucleic (ARN) și care este rolul său principal în celulă?
Acidul ribonucleic (ARN) este o moleculă esențială care transmite și execută informațiile genetice codificate în ADN. ARN-ul participă activ în transcriere, traducere, reglarea expresiei genice și chiar în reacții catalitice.
2. Care sunt principalele diferențe între ARN și ADN?
ARN-ul conține riboză, uracil în loc de timină și este de obicei monocatenar. Comparativ cu ADN-ul, ARN-ul este mai instabil, dar mult mai versatil din punct de vedere funcțional.
3. Ce tipuri de ARN există și ce funcții au?
Există mai multe tipuri de ARN, inclusiv:
- ARNm: transportă informația genetică pentru sinteza proteinelor;
- ARNt: aduce aminoacizii la ribozom;
- ARNr: formează structura ribozomilor;
- miARN, siARN, ARNlnc, ARNcirc: reglează expresia genică și alte procese celulare.
- 4. Cum contribuie ARN-ul la dezvoltarea terapiilor moderne?
Tehnologiile bazate pe ARN, cum ar fi siARN, oligonucleotidele antisens și vaccinurile ARNm, sunt utilizate pentru tratamentul bolilor genetice, virale și chiar în oncologie, marcând o revoluție în medicina personalizată.
5. Ce este ipoteza lumii ARN și de ce este importantă pentru înțelegerea originii vieții?
Ipoteza lumii ARN propune că viața a început cu molecule de ARN capabile să se autoreplice și să catalizeze reacții. Această teorie este susținută de descoperirea ribozimelor și de rolurile fundamentale ale ARN-ului în celulele moderne.
Concluzie
Acidul ribonucleic reprezintă mult mai mult decât un simplu intermediar în fluxul informației genetice. De la rolul său central în sinteza proteică, la funcțiile sale catalitice și reglatoare, ARN-ul continuă să ne uimească prin diversitatea și complexitatea sa funcțională. Descoperirile din ultimele decenii au transformat dramatic înțelegerea noastră despre biologia celulară și moleculară, plasând ARN-ul în centrul multor procese fundamentale.
Cercetarea ARN-ului ne-a oferit perspective valoroase despre originea vieții și evoluția sistemelor biologice. În același timp, aceste cunoștințe au deschis calea pentru dezvoltarea unor tehnologii și terapii revoluționare, de la interferența ARN și editarea genomică, până la vaccinurile ARNm și terapiile genice.
Pe măsură ce continuăm să explorăm universul complex al acidului ribonucleic, putem anticipa descoperiri și aplicații noi care vor avea impact profund asupra înțelegerii științifice și asupra medicinei. ARN-ul rămâne o moleculă remarcabilă, un protagonist central al vieții, care continuă să ne dezvăluie noi secrete și să ne inspire noi direcții de cercetare și inovare.
Bibliografie și resurse suplimentare
- Cech TR, Steitz JA. (2014). The noncoding RNA revolution—trashing old rules to forge new ones. Cell, 157(1), 77-94.
- Morris KV, Mattick JS. (2014). The rise of regulatory RNA. Nature Reviews Genetics, 15(6), 423-437.
- Djebali S, et al. (2012). Landscape of transcription in human cells. Nature, 489(7414), 101-108.
- Hüttenhofer A, Schattner P, Polacek N. (2005). Non-coding RNAs: hope or hype? Trends in Genetics, 21(5), 289-297.
- Fedor MJ, Williamson JR. (2005). The catalytic diversity of RNAs. Nature Reviews Molecular Cell Biology, 6(5), 399-412.
- Gilbert W. (1986). Origin of life: The RNA world. Nature, 319(6055), 618.
- Karikó K, et al. (2008). Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Molecular Therapy, 16(11), 1833-1840.
- Pardi N, et al. (2018). mRNA vaccines—a new era in vaccinology. Nature Reviews Drug Discovery, 17(4), 261-279.
- Crooke ST, et al. (2018). RNA targeted therapeutics. Cell Metabolism, 27(4), 714-739.
- Roundtree IA, et al. (2017). Dynamic RNA modifications in gene expression regulation. Cell, 169(7), 1187-1200.