Citoplasma
- Detalii
- Categorie: Biologie celulară
- Accesări: 24,832
Citoplasma este partea fluidă a celulei care se află între membrana celulară și nucleu. Este compus dintr-o substanță gelatinoasă numită citosol, în care sunt suspendate diferite organite celulare (cum ar fi mitocondriile, ribozomii, reticulul endoplasmatic etc.).
Citoplasma - (hialoplasma, matricea citoplasmatică sau citosolul) Etimologie: kytos gr.= celulă, plasma gr.= formaţie
Caracterele generale ale citoplasmei
Citoplasma este acea parte a conţinutului celular aflată în afara organitelor celulare şi a nucleului, dar cu care menţine permanent relaţii metabolice complexe. Ultrastructura ei a fost pusă în evidenţă cu ajutorul microscopului electronic, fiind observate o serie de diferenţieri citoplasmatice, ce formează în spaţiul celular o reţea complexă, numită citoschelet.
Keith Porter [1978-1979], cu microscopul electronic de înalt voltaj, a observat în celulele eucariote o reţea de filamente de 6 nm în diametru, pe care a numit-o reţea microtrabeculară, ce interconectează organitele citoplasmatice cu elemente de citoschelet într-o unitate morfo-funcţională numită citoplasmă.
Ce rol are citoplasma
Citoplasma are un rol esențial în funcționarea celulei, fiind mediul în care au loc majoritatea proceselor celulare. Iată principalele sale roluri:
- Susținerea organitelor – Asigură un mediu în care organitele celulare sunt suspendate și pot funcționa corespunzător.
- Transportul substanțelor – Permite circulația moleculelor și a ionilor între diferitele părți ale celulei.
- Locul reacțiilor metabolice – Multe procese biochimice, precum glicoliza și sinteza proteinelor, au loc în citoplasmă.
- Depozitarea substanțelor – Poate reține rezerve de nutrienți, enzime și alte molecule esențiale pentru celulă.
- Transmiterea semnalelor – Contribuie la comunicarea intracelulară și la răspunsurile celulare la stimuli externi.
Citoplasma este formată dintr-o parte lichidă numită citosol, organite și incluziuni celulare. În celulele eucariote, citoplasma exclude nucleul, în timp ce în celulele procariote conține întregul material genetic.
Citoplasma este prezentă atât în celulele eucariote (cele care au nucleu, cum sunt cele animale și vegetale), cât și în cele procariote (bacterii, care nu au nucleu delimitat)
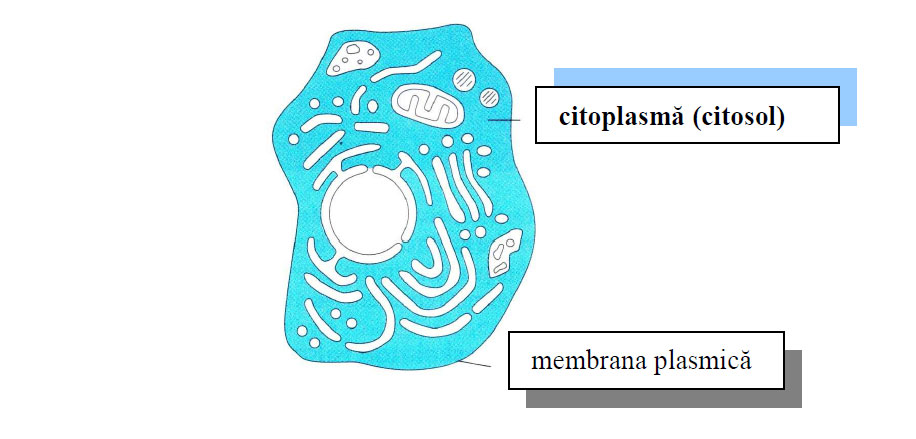
Figura 1 - Repartizarea citoplasmei în celulă (după Alberts et al., 2010)
Caracterizarea fizico-chimică a citoplasmei
În stare proaspătă, citoplasma este incoloră, transparentă, elastică, contractilă, coagulabilă la căldură, iar la microscopul optic are aspect omogen sau granulos, uneori cu numeroase formaţiuni ca adaptări în vederea îndeplinirii unor funcţii sau produşi de elaborare / rezervă celulară. Chimic, citoplasma conţine apă în proporţie de 70-85%, ioni anorganici 2-3% (Na+, K+, Mg2+, Ca2+, Fe2+, Cl- , PO43+, SO42-) şi substanţe organice 13-28% (proteine, glucide, lipide, nucleotide, ARN).
Citoplasma se află într-o continuă tranziţie sol-gel, ce îi conferă un dinamism specific şi propriu. Tranziţiile pot fi induse atât de factori endogeni (faza sintetică a ciclului celular şi metabolismul celular), cât şi de factori exogeni (temperatură, pH, lumină).
Funcţia citoplasmei în celulă
Citoplasma exercită multiple funcţii în celulă:
- joacă un rol important în inducerea, adaptarea şi menţinerea formei celulei faţă de necesităţi;
- are rol în mişcările celulare prin proteinele contractile ce alcătuiesc reţeaua microtrabeculară şi care cooperează cu elementele din citoschelet;
- este sediul unor procese metabolice importante;
- este depozit intracelular pentru proteine contractile, glicogen, lipide, monomeri, ioni, pigmenţi, substanţe minerale, apă ş.a.
Diferenţierile citoplasmatice
Filamentele de miozină
Filamentele de miozină au fost descrise iniţial în celulele musculare, unde au structură tipică sub formă de filamente groase, iar în celulele nemusculare au dimensiuni mult mai reduse şi caracter tranzitoriu. Filamentele de miozină se formează prin polimerizarea unor proteine, numite miozine.
În celulele musculare polimerizează circa 500 de molecule de miozină pentru a forma filamentele groase, cu diametrul de 10-20 nm, dispuse paralel cu filamentele subţiri de actină şi aranjate într-o reţea hexagonală, în raport de 1:6. În acest caz, rolul filamentelor groase este de a produce contracţia musculară, prin interacţiunea lor cu filamentele de actină.
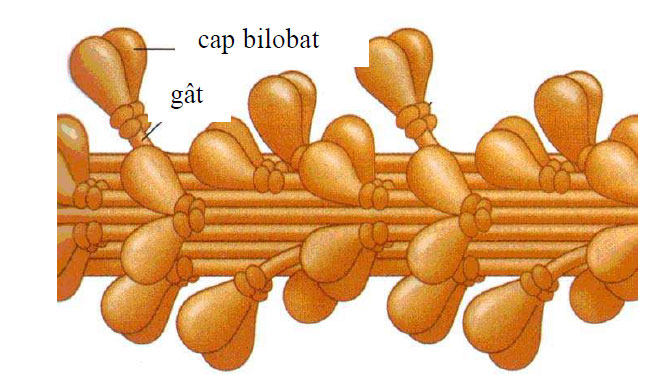
Figura 2 - Schita filamentului gros de miozină (după Moyes and Schulte, 2008)
Filamentele de actină (microfilamente)
Filamentele de actină apar în toate celulele eucariote, unde reprezintă circa 5-15% din totalul proteinelor. Ele sunt izolate, au o distribuţie citoplasmatică relativ difuză şi dinamică, participând alături de microtubuli şi filamente intermediare la organizarea structurii complexe a citoscheletului.
Actina este un polipeptid , cu aspect globular (diametru de 4 nm), de unde denumirea ei de actină globulară sau actină G (forma monomerică).
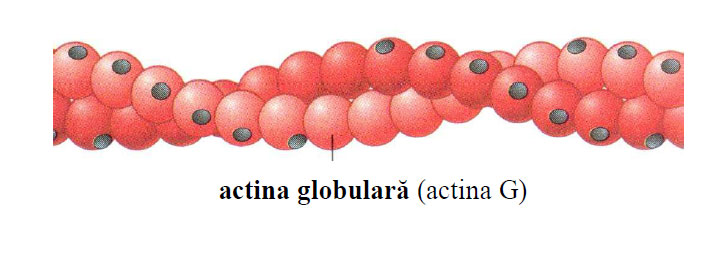
Figura 3 - Schita filamentului subtire de actină (2 lanturi de actină F) (după Moyes and Schulte, 2008)
Fiecare moleculă de actină G are asociat un ion de calciu, strâns legat pentru a-i stabiliza conformaţia globulară şi o moleculă de ATP. Actina G polimerizează, generând actina fibrilară sau actina F (forma polimerică) cu aspect de filamente. În celulele musculare, filamentele de actină mai conţin o serie deproteine asociate: tropomiozina, troponina şi alpha-actinina.
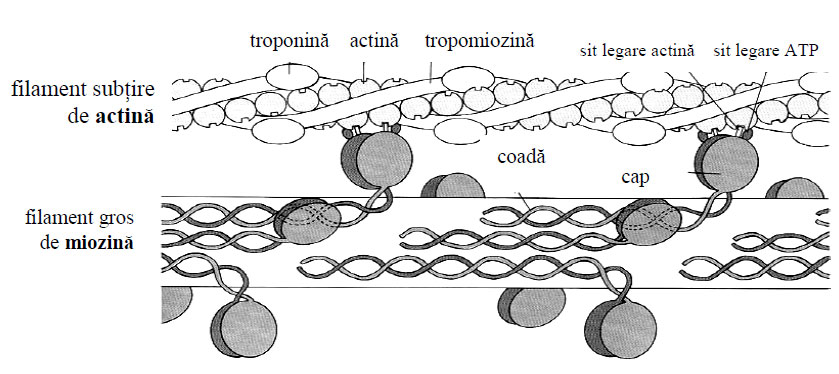
Figura 4 - Schema interacţiunii miozinei cu actina şi prezenţa proteinelor de asociere ale actinei (după Fox, 1991)
O serie de droguri pot avea efecte de inhibare sau de stimulare aproceselor de polimerizare ale actinei G. De exemplu, citocatalazinele B, C şi D (familie de metaboliţi secretaţi de diferite mucegaiuri) inhibă polimerizarea actinei, cu repercursiuni asupra mişcărilor celulare de tip amiboidal şi fagocitar.
Faloidina, un alcaloid foarte toxic produs de o ciupercă (Amanita phalloides sp.), inhibă depolimerizarea filamentelor de actină, stabilizându-le structura.
Filamentele intermediare
Filamentele intermediare, la microscopul electronic, apar rectilinii sau uşor curbate, au un diametru mediu de 10 nm (8-12 nm), fiind mai groase decât filamentele de actină şi mai subţiri decât microtubulii. Subunităţile proteice sunt molecule filiforme, ce polimerizează prin alăturare şi împletire (cu aspect de frânghie) în structuri rezistente, mult mai stabile.
La vertebratele superioare s-au identificat 7 tipuri de molecule proteice distincte, ce intră în structura filamentelor intermediare:
- citokeratinele
- vimentina
- desmina
- neurofilamentele
- proteina glială fibrilară acidă
- laminele nucleare
- nestina
Dezasamblarea filamentelor intermediare se poate face prin digestia lor cu enzime proteolitice specifice, activate în prezenţa ionilor de calciu.
Importanta filamentelor intermediare constă mai ales în identificarea tipurilor lor prin utilizare de anticorpi monoclonali îndreptaţi împotriva proteinelor componente, în vederea diagnosticării tumorilor maligne:
- carcinoamele au filamente de keratină,
- sarcoamele au filamente de vimentină,
- rabdomiosarcoamele au filamente de desmină,
- neuroblastoamele au neurofilamente,
- glioamele au filamente gliale.
Microtubulii
Etimologie: mikros gr.= mic, tubulus lat.= tub mic
Microtubulii apar în citoplasmă majorităţii celulelor eucariote , fie liberi (izolaţi) numiţimicrotubuli citoplasmatici, fie sub formă fasciculată (de mănunchiuri) în structuri celulare temporare ca fusul de diviziune sau în structuri permanente ca axul cililor şi flagelilor, în centrioli şi corpusculi bazali.
Au fost observaţi pentru prima dată la microscopul electronic în 1967 de către Henry Moor, ca dimeri tubuline dispuşi spiralat într-un unghi de 10- 15o înclinaţie faţă de axul longitudinal al microtubulului.
La microscopul electronic microtubulii apar ca structuri cilindrice rectilinii, de lungimi variabile (până la circa 200 pm la flageli) şi cu un diametru relativ constant de 20-24 nm. Ei se formează prin polimerizarea unor proteine globulare, numite tubuline, a-tubulina şi R-tubulina , cu secvenţe asemănătoare de aminoacizi. Fiecare microtubul este format din 13 asemenea protofilamente, care delimitează un lumen la interior.
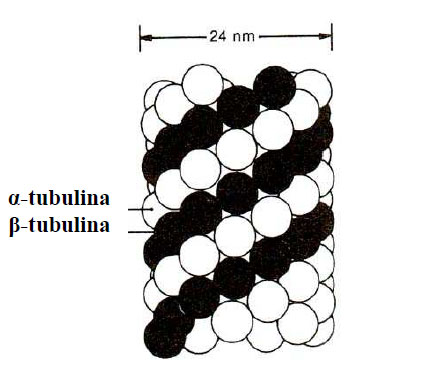
Figura 5 - Asamblarea subunitătilor tubuline (după Johnson, 1991)
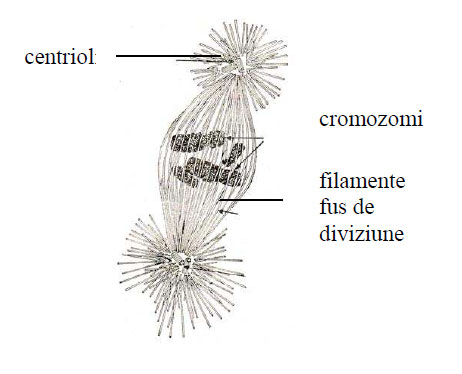
Figura 6 - Fus de diviziune cu microtubuli tubuline (după Johnson, 1991) (după Diculescu si col., 1983)
Originea microtubulilor
In 1969, M.J. Bajer a enunţat ipoteza formării „e novo” a microtubulilor. Pe lângă această ipoteză, distribuţia strictă în celulă a microtubulilor a condus la o a doua ipoteză, cea a existenţei unor factori ce controlează nucleaţia, diferenţierea şi dispunerea acestor formaţiuni celulare. Experimental a fost demonstrată existenţa acestor factori, care au fost numiţi centrii organizatorici ai microtubulilor (MOC) sau centrii de nucleaţie.
In prezent, există destule dovezi care atestă că cel puţin centriolii şi corpusculii bazali pot acţiona ca centrii organizatorici ai microtubulilor.
Microtubulii au o orientare strictă faţă de centrele de nucleaţie. De exemplu, într-o celulă ciliată aflată în interfază, s-a observat că microtubulii citoplasmatici au capătul (-) orientat şi ancorat în regiunea din jurul centriolilor, iar microtubulii din axonemă au capătul (-) poziţionat în apropierea corpusculului bazal.
In celula nervoasă, microtubulii din axon sunt orientaţi cu capătul (-) spre centriol, pe când cei din dendrite nu au o orientare strictă. Sechestrarea şi stabilizarea capetelor explică de ce in vivo adăugarea sau disocierea dimerilor de tubuline are loc numai la capetele (+) libere.
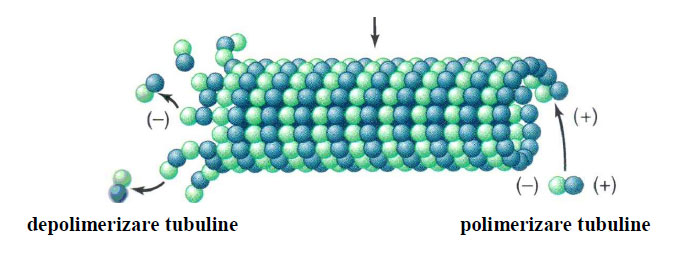
Figura 7 - Polimerizarea si depolimerizarea subunitătilor tubuline într-un microtubul (după Moyes and Schulte, 2008)
Funcţiile microtubulilor
Microtubulii au un rol structural determinând forma spaţială a celulei şi a prelungirilor ei permanente (axoni, dendrite, cili, flageli). În cursul diferenţierii, ei favorizează modificarea formei celulelor.
Microtubulii au rol de organizatori ai citoscheletului determinând distribuţia în celulă a filamentelor intermediare. Microtubulii au funcţie de schele temporare, încât celula îşi poate construi aranjamentele specifice.
Microtubulii au un rol dinamic, prin asigurarea tuturor mişcărilor celulare (cili, flageli), ce au la bază mecanismul molecular microtubul-dyneină.
Microtubulii au rol în diviziunea celulară, mai precis în formarea fusului de diviziune, în deplasarea cromozomilor în planul ecuatorial al celulei, alinierea lor pe placa metafazică şi în translocarea cromozomilor anafazici.
Microtubulii au rol în stricta orientare a transportului intracelular a unor organite, vezicule sau particule organice.
Citoscheletul
Citoscheletul celulelor eucariote este alcătuit, în principal, din trei tipuri de diferenţieri citoplasmatice: microfilamente de actină, microtubuli şi filamente intermediare.
Ele sunt interconectate într-o reţea complexă tridimensională, ce străbate întreaga citoplasmă, având capacitatea de a-şi modifica structura în funcţie de necesităţile celulei.

Figura 8 - Citoscheletul, TEM 250.000x (după Darnell et al., 1988)
Dinamismul citoscheletului este foarte mult influenţat de prezenţa ionilor de calciu ce induc polimerizarea sau depolimerizarea tubulinelor şi reglează interacţiunea actină-miozină în procesele de contracţie/relaxare musculară.
Iniţial s-a crezut că structura citoscheletală ar fi prezentă doar la celulele eucariote, dar în 2006 au fost identificate la procariote proteine majore omoloage citoscheletului eucariot (Y.L. Shih, L. Rothfield; K.A. Michie, J. Lowe; A. Briegel et al.; N. Ausmees et al.). În celulele procariote bacteriene au fost identificaţi omologi ai majorităţii proteinelor ce alcătuiesc citoscheletul la eucariote, cum ar fi: proteina FtsZ, proteinele MreB şi ParM, crescentina şi sistemul MinCDE.
Funcţiile citoscheletului
Funcţiile citoscheletului sunt:
- funcţia de susţinere, prin inducerea şi menţinerea formei celulei şi a prelungirilor ei (cili, microvili, flageli, axoni);
- prin componentele sale se realizează o serie de mişcări celulare (a cililor şi flagelilor, deplasarea celulelor, translocarea cromozomilor pe durata diviziunii celulare, contracţia/ relaxarea celulelor musculare);
- de interacţiune a elementelor de citoschelet cu plasmalema la nivelul joncţiunilor, cărora le conferă rezistenţă la factorii mecanici;
- stabileşte legături cu proteinele intrinseci din membrană, cu rol în transmiterea de informaţii în cazul mişcărilor de locomoţie celulară şi în inhibiţia de contact specifică proliferării normale a celulelor cultivate;
- interacţionează cu organite celulare , iar în asociere cu filamentele intermediare se pare că interacţionează şi cu nucleul;
- participă la menţinerea în poziţie şi la deplasările în celulă a unor organite;
- asigură transportul intracelular de particule materiale, vezicule de transfer, transportul unor proteine în lungul axonului celulei nervoase.
În celula canceroasă citoscheletul este mult modificat ca structură şi organizare, aspectul lui servind la diagnosticarea tumorilor.
Microtrabeculele
La microscopul electronic de voltaj supraînalt, s-au observat în citoplasma unor celule nişte structuri fibrilare mai subţiri decât filamentele citoscheletului, numite microtrabecule de către Keittth Porter [1978-1979]. Ele formează o reţea ce străbate întreaga citoplasmă, în ochiurile reţelei găsindu-se molecule de apă şi ioni.
Microtrabeculele au un diametru de circa 4-6 nm, iar prin organizarea lor spaţială menţin suspendate în citosol atât organitele cât şi citoscheletul. Se consideră că reţeaua microtrabeculară este formată din peste 100 de tipuri de proteine, din care au fost identificate cu certitudineactina, miozina, tubulina şi dyneina.
S-a putut demonstra că de microtrabecule sunt legate o serie de enzime din citosol, ceea ce ar asigura trecerea coordonată a substratului de la o enzimă la alta (enzimele glicolizei). Structura reţelei de microtrabecule prezintă un dinamism accentuat, cu modificări reversibile induse de diferiţi factori: temperatură, pH, presiune hidrostatică, inhibitori ai proceselor metabolice din celulă ş.a.
Rolul microtrabeculelor
Microtrabeculele asigură:
- controlul formei, al motilităţii celulare şi coordonează transportul intracelular alături de citoschelet;
- asigură susţinerea tuturor organitelor şi a structurilor celulare specifice;
- asigură orientarea strictă în spaţiu a unor enzime implicate în procesele biochimice din citoplasmă;
- protejează celula în cazul unor fluctuaţii ale conţinutului de apă.
Întrebări frecvente despre citoplasmă
1. Ce este citoplasma și care este rolul ei în celulă?
Citoplasma este partea fluidă a celulei aflată între membrana celulară și nucleu. Ea susține organitele, facilitează reacțiile metabolice, transportul intracelular și comunicarea între componentele celulare.
2. Din ce este compusă citoplasma?
Citoplasma este alcătuită din citosol (componenta lichidă), organite celulare (precum mitocondrii, ribozomi, reticul endoplasmatic) și incluziuni. Are o compoziție fizico-chimică complexă, cu 70–85% apă și numeroși ioni și molecule organice.
3. Ce sunt microtubulii și ce funcție îndeplinesc în citoplasmă?
Microtubulii sunt structuri cilindrice formate din proteine numite tubuline. Ei oferă suport structural, intervin în diviziunea celulară, transportul intracelular și mișcarea flagelilor și cililor.
4. Cum contribuie citoscheletul la funcționarea celulei?
Citoscheletul oferă structură, stabilizează forma celulei, facilitează mișcarea organitelor, diviziunea celulară și transportul intracelular. Este compus din microfilamente, microtubuli și filamente intermediare.
5. Ce rol joacă microtrabeculele în celulă?
Microtrabeculele formează o rețea fină care susține organitele și citoscheletul în citosol. Ele coordonează localizarea enzimelor și contribuie la controlul formei celulei și la protecția în fața variațiilor de apă.