Organitele citoplasmatice
- Detalii
- Categorie: Biologie celulară
- Accesări: 47,839
Organitele citoplasmatice sunt structuri specializate din citoplasmă, fiecare având un rol distinct în funcționarea celulei. Acestea pot fi împărțite în două categorii principale: organite cu membrană și organite fără membrană.
Organite cu membrană
- Nucleul – Conține materialul genetic (ADN) și controlează activitățile celulare.
- Mitocondriile – "Centralele energetice" ale celulei, responsabile pentru producerea de ATP prin respirație celulară.
- Reticulul endoplasmatic (RE)
- RE rugos – Are ribozomi atașați și este implicat în sinteza proteinelor.
- RE neted – Nu are ribozomi și este responsabil pentru sinteza lipidelor și detoxifiere.
- Aparatul Golgi – Modifică, sortează și distribuie proteinele și lipidele sintetizate.
- Lizozomii – Conțin enzime digestive care descompun deșeurile celulare și particulele străine.
- Peroxizomii – Descompun peroxizii și ajută la detoxifierea celulei.
- Vacuolele – Mai mari în celulele vegetale, depozitează substanțe nutritive și deșeuri.
- Cloroplastele (doar în celulele vegetale) – Realizează fotosinteza.
Organite fără membrană
- Ribozomii – Responsabili pentru sinteza proteinelor.
- Centrozomii și centriolii – Implicați în diviziunea celulară și organizarea citoscheletului.
- Citoscheletul – Rețea de filamente proteice care menține forma celulei și facilitează mișcarea organitelor.
Aceste organite lucrează împreună pentru a asigura funcționarea optimă a celulei, fiecare având un rol esențial în metabolismul și supraviețuirea acesteia.
Ribozomii (granulele lui Palade)
Etimologie: ribos gr.= granulă, soma gr.= corp (în trad liberă - corpi granuloşi)
Ribozomii sunt organite citoplasmatice prezente atât în celulele procariote cât şi în cele eucariote, cu puţine excepţii, ca de exemplu eritrocitele mature ale mamiferelor.
Ribozomii au fost observaţi pentru prima dată în 1953 la microscopul electronic de către George Emil Palade, iar din 1961 au fost numiţi ribozomi (ribosomes).
La microscopul optic un ribozom nu este observabil din cauza dimensiunilor sale foarte reduse, însă, atunci când ribozomii sunt aglomeraţi în număr mare într-o anumită zonă din citoplasmă, aşa cum este cazul celulelor în care are loc o sinteză intensă de proteine, prezenţa lor poate fi evidenţiată prin fenomenul de bazofilie, ceea ce demonstrează că la nivelul acestor organite se află cantităţi importante de ARN (circa 85% din ARN-ul celular).
Ribozomii conţin ARN, din care 75-80% este ARNr (ribozomal), 5-10% ARNm (mesager), iar restul este ARNt (de transport). Pe lângă ARN, ribozomii mai conţin numeroase proteine ribozomale.
La microscopul electronic ribozomii apar ca structuri mici , granulare, electronodense, nedelimitate de endomembrane. Ei pot fi sub formă de ribozomi liberi, răspândiţi în citoplasmă, fie izolaţi, fie grupaţi în şiraguri cu aspect de rozetă sau de spirală. Ei se mai găsesc în matricea mitocondriilor, dar şi în cea a cloroplastelor din celulele vegetale.
Prezenţa ribozomilor mai poate fi ca ribozomi ataşaţi, adică ribozomi ce aderă la faţa externă a membranelor ce delimitează veziculele, canaliculele, sacii sau cisternele reticulului endoplasmatic, de unde şi numele de reticul endoplasmatic granular (REG). Ribozomii mai apar ataşaţi la suprafaţa externă a învelişului nuclear, deoarece se ştie că este în continuitate directă cu membrana tubulilor reticulului endoplasmatic granular.
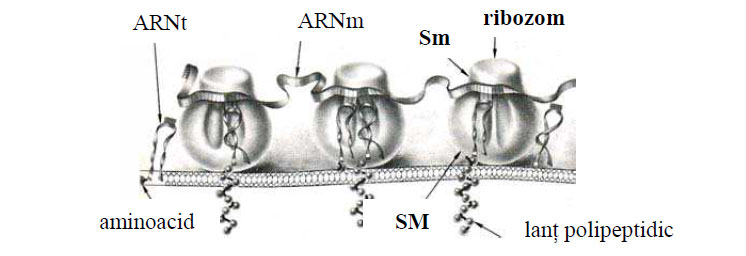
Figura 39 Poliribozomi atasati la membrana reticulului endoplasmatic granular: Sm – subunitatea mică; SM – subunitatea mare (după Bloom et al., 1975)
Numărul ribozomilor dintr-o celulă variază mult în funcţie de tipul de celulă, de specializarea ei funcţională, de vârstă, de momentul fiziologic considerat etc., acesta fiind mai mare (circa 5 milioane) în celulele glandulare, implicate în sinteza unor produşi proteici.
Diametrul ribozomilor este relativ constant, de 20-30 nm la eucariote. Ribozomii bacterieni, precum şi cei din matricea mitocondriilor şi a cloroplastelor sunt ceva mai mici.
Ca formă, ribozomii sunt structuri asimetrice, având la eucariote diametrul mare de 32 nm, iar cel mic de 22 nm. Aceste două diametre rezultă din faptul că ribozomul este format din două subunităţi ribozomale inegale: o subunitate ribozomală mare şi o subunitate ribozomală mică. Aceste două subunităţi sunt caracterizate prin masa lor moleculară exprimată în Daltoni (da) şi prin viteza lor de sedimentare în ultracentrifugă exprimată în unităţi Svedberg (S).
Ribozomii la eucariote au o masă moleculară de 4,5x106 da, o constantă de sedimentare de 80S şi diametrele de 32/22 nm.
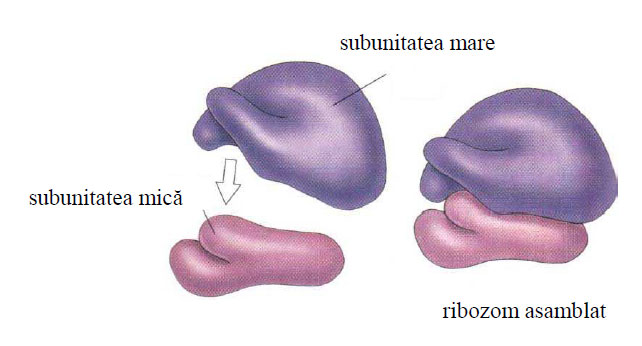
Figura 40 - Schiţa unui ribozom eucariot de 80S (după Web of Natural Toxins Research Center, Texas A&M University, Kingsville, 2004)
Ribozomii aflaţi singuratici în matricea citoplasmatică sunt inactivi metabolic. Semnul sigur că ei s-au angajat în procesul de sinteză a proteinelor este acela că s-au grupat mai mulţi la un loc, în şiraguri, formând poliribozomi.
Formarea lor este posibilă doar în prezenţa unui ARNm, care preia informaţia în nucleu, copiind anumite gene ale ADN-ului cromozomal, informaţie pe care o duce în citoplasmă la ribozomi, adică la organitele sintezei de proteine.
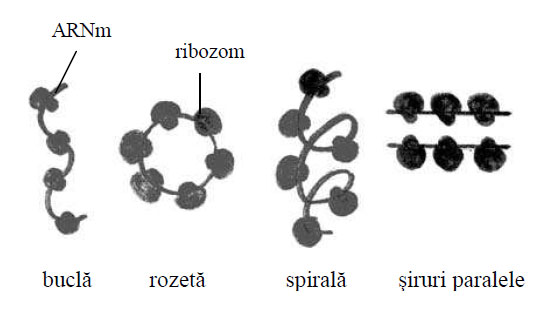
Figura 41 - Forme de grupare ale poliribozomilor
La organismele eucariote există cel puţin un tip de ARNt pentru fiecare din cei 20 de aminoacizi. Indiferent ce tip de aminoacid vor exporta, moleculele de ARNt au o structură asemănătoare. Moleculele proteice, aşa cum rezultă ele iniţial, chimic sunt incomplete, iar funcţional sunt inactive.
Ele vor fi supuse în continuare unor modificări complexe (modificări cotranslaţionale), când proteina în formare pătrunde în lumenul REG, iar apoi în cisternele şi în veziculele complexului Golgi (modificări post-translaţionale). Prin toate aceste modificări proteina iniţială sau pro-proteina va ajunge în final proteină matură activă.
Originea ribozomilor se află în nucleol la nivelul unui ADN extracromo-zomial, care face parte în mod normal din structura nucleolului. Acest ADN ribozomal (ADNr) a fost transcris pe genele unor anumiţi cromozomi, numiţi organizatori nucleolari, iar pe el va avea loc transcrierea moleculelor de ARNr, care prin asociere cu anumite proteine din citoplasmă vor forma precursorii ribozomali sau particulele ribozomale proteice.
Acestea vor trece în citoplasmă, traversând învelişul nuclear prin pori, unde vor putea fi identificate ca subunităţi ribozomale (mari şi mici) neasamblate. Asamblarea lor ca ribozomi întregi are loc în momentul în care ei devin funcţionali în procesul sintezei de proteine. Existenţa ribozomilor este relativ scurtă, deoarece la finele procesului de sinteză proteică cele două subunităţi ribozomale se separă în citoplasmă, unde sunt metabolizate şi dispar.
Funcţiile ribozomilor
Rolul principal al ribozomilor este acela de a participa la sinteza de proteine. In acest proces, ARNr în cooperare cu ARNm, ARNt şi cu alte proteine, realizează traducerea codului genetic pentru asamblarea aminoacizilor în lanţuri polipeptidice, pe care apoi le eliberează în matricea citoplasmatică sau în lumenul reticulului endoplasmatic.
Poliribozomii ataşaţi reticulului endoplasmatic sintetizează proteine destinate compartimentului extracelular, numite proteine „de export” sau proteine „pentru uz intern”, cum sunt enzimele din lizozomi sau proteinele din structura citomembranelor. Proteinele sintetizate de poliribozomii liberi vor fi eliberate direct în matricea citoplasmatică.
Centrozomul (centrul celular)
A fost observat pentru prima dată în anul 1876 de către Edouard van Beneden, prezenţa lui în celulă fiind confirmată ceva mai târziu de către Theodor Boveri.
Centrozomul este prezent în aproape toate tipurile de celule animale şi umane, dar nu apare în celula absorbantă, în celula musculară striată şi în hematii.
Localizare centrozomului
In general, centrozomul se află în apropierea învelişului nuclear sau în zona apicală a unor celule (în nefrocite sub platoul lor striat). Centrozomul nu este un organit rigid, ci execută mişcări de mică amplitudine, stabilind relaţii cu zona Golgi şi cu zona mitocondriilor.
Morfologia şi ultrastructura centrozomului
La microscopul optic în interfază centrozomul este intens cromatic, prezentând 1-2 formaţiuni distincte, numite centrioli, înconjuraţi de citoplasmă densă, omogenă şi slab colorată bazofil, numită centrosferă, din care în timpul diviziunii celulare apar filamente radiare ce se răspândesc în citoplasma limitrofă formând asterulfusului de diviziune.
La microscopul electronic centriolii apar ca nişte formaţiuni cilindrice, lungi de 0,5 pm şi cu diametrul de 0,15 pm. Peretele centriolului este format din 9 tubuli dubli sau tripli, cu diametrul de circa 150-200 Å. În exteriorul peretelui se află dispuse două rânduri de sferule proteice suprapuse, din care îşi vor avea originea filamentele scurte şi cele lungi ale fusului de diviziune. Centriolii conţin proteine bazice şi acide (contractile), mucopoliglucide, ARN şi protein-enzime (fumaraza, succindehidrogenaza).
Figura 42 - Centriol în celulă pancreatică de găină, 180.000x (după Loewy et al., 1974)

Figura 43 - Schiţă 3D de centrioli (după Fox, 1991)
Funcţiile centrozomului
Centrozomul elaborează şi polimerizează proteinele de rezervă, iar în timpul diviziunii celulare asigură sinteza proteinelor din fusul de diviziune, coordonează mişcările intracelulare de tipul ciclozei pentru deplasarea organitelor şi amestecul macromoleculelor citoplasmatice şi a mişcărilor cililor şi flagelilor.
Centriolii asigură reorganizarea centrozomilor celulelor-fiice la sfârşitul diviziunii celulare.
Reticulul endoplasmatic
Etimologie: reticullum lat.= reţea mică
În anul 1954, Albert Claude şi Fullam, iar apoi George Emil Palade şi Keith Porter au pus în evidenţă la microscopul electronic în celule de mamifere, de plante şi de bacterii o reţea de canalicule, pe care le considerau dezvoltate în raport cu gradul de diferenţiere şi de activitate ale celulelor respective.
Morfologia şi ultrastructura reticulul endoplasmatic
Reticulul endoplasmatic este format din cavităţi polimorfe, cu diametrul de circa 250-3.000 Å, cu aspect de tubuli, vezicule sau cisterne.
Compoziţia chimică reticulul endoplasmatic
Cavităţile reticulului endoplasmatic conţin apă, lipide, proteine şi substanţe minerale.
Relaţiile topo-functionale ale reticulului endoplasmatic se stabilesc cu pliurile interne ale plasmalemei, cu membrana externă a învelişului nuclear şi cu spaţiul perinuclear, cu complexul Golgi prin microveziculele de transfer şi cu mitocondriile în urma răsucirii tubilor de reticul în jurul lor.
Originea organitului este explicată prin mai multe ipoteze: ar proveni fie din componenţii tubulari sau vacuolari existenţi în citoplasmă din care s-ar forma cavităţi libere, ce se unesc apoi în reţea; ar proveni din membrana celulară; este considerat un sistem autonom capabil de reproducere în timpul diviziunii celulare, prin aglomerarea membranelor organitului la cei doi poli ai celulei-mamă.
Reticulul endoplasmatic neted (agranular, citomembrane P sau REN) nu are ataşaţi ribozomi pe faţa externă a membranei lui, este alcătuit exclusiv din tubuli în celulele ce sintetizează şi depozitează lipide şi în celule ce elaborează hormoni steroizi (adipocite, hepatocite, celule pigmentare, celule musculare striate, celule Leydig).
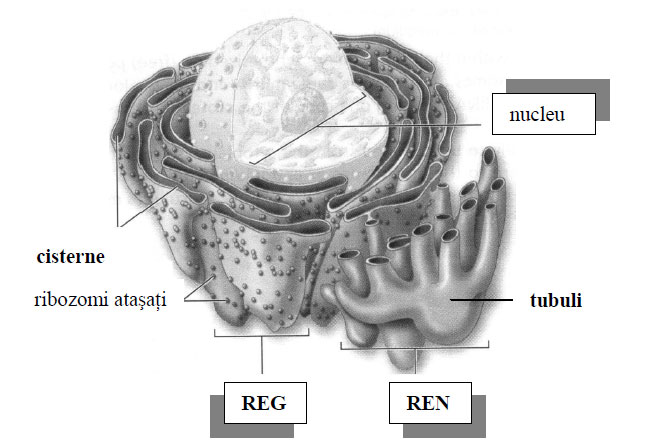
Figura 44 - Schiţă a reticulului endoplasmatic neted şi granular după imagine SEM (după Mescher, 2010)
Reticlul endoplasmatic granular (rugos, citomembrane a sau REG) a fost observat lamicroscopul optic de către Solger în 1897, care i-a dat numele deergastoplasmă. Ia aspectul unor cisterne sau lame aplatizate, paralele şi puternic bazofile pe preparate microscopice, dispuse în citoplasma bazală a celulelor secretoare. Pe faţa externă a membranei are ataşaţi ribozomi, de unde şi denumirea de rugos sau granular.
În funcţie de tipul celular, reticulul endoplasmatic granular ia mai multe aspecte şi denumiri astfel:
- corpi tigroizi sau corpusculi Nissl în celulele nervoase,
- corpii lui Berg în hepatocite,
- ergastoplasmă în celulele pancreatice şi în celulele din glandele salivare.
La microscopul electronic reticulul endoplasmatic granular are aspect de tubuli paraleli sau de canalicule cu diametrul de 50-150 Å, cu ribozomi ataşaţi sub formă de poliribozomi în rozetă, în spirală sau în şiruri paralele. Tubulii sunt separaţi între ei prin spaţii cu diametrul de 150-350 Å, fiind bine reprezentaţi în celulele care secretă proteine de export (neuroni, fibroblaste, celule glandulare, celule caliciforme).

Figura 45 - Reticul endoplasmatic neted, cortex glandă suprarenale, 50.000x (după Bloom et al, 1975)

Figura 46 - Reticul endoplasmatic granular, sectiune celulă glandulară, TEM 90.000x (după Bloom et al, 1975)
Funcţiile reticulului endoplasmatic
Reticulul endoplasmatic reprezintă aparatul circulator intracito- plasmatic, ce asigură schimburile permanente dintre celulă şi mediul extracelular, asigură şi reglează circulaţia hidrică în celulă prin membranele lui selective, asigură legătura directă a nucleului cu mediul extracelular, iar în celulele nervoase are rol în difuzarea intracelulară a influxului nervos.
Reticulul endoplasmatic granular are rol în sinteza proteinelor „de export” destinate cito-membranelor şi secreţiei, iar cel neted are rol însinteza lipidelor, hormonilor steroizi, în metabolismul carbohidraţilor şi în stocarea calciului.
S-a reuşit punerea în evidenţă a funcţiei de detoxifiere, prin care substanţele xenobiotice de tipul barbituricelor, a morfinei, a codeinei, a pesticidelor şi a substanţelor cancerogene pot fi neutralizate prin procese de oxidare, hidroxilare şi conjugare cu aminoacizi devenind astfel apoase, adică epurabile.
Aparatul Golgi (complex sau zona Golgi)
A fost descris la sfârşitul secolului al 19-lea, în 1897 de către Camillo Golgi ca un aparat reticular intern, pe secţiuni din ganglion spinal de pisică impregnate cu azotat de argint. După 1954, cu ajutorul microscopului electronic, Dalton şi Felix au confirmat existenţa organitului şi i-au dat numele de aparat Golgi.
Organitul este prezent în majoritatea celulelor vertebratelor şi nevertebratelor, la alge, fungi, plante şi om. Excepţie fac hematiile în care organitul este absent.
Localizarea în citoplasmă poate fi peri-nucleară în celulele sferice, juxta-nucleară în celulele prismatice, apicală în celulele piramidale, subnucleară în celulele caliciforme.
Structura şi ultrastructura
La microscopul optic prin impregnare argentică, organitul manifestă o mare plasticitate cu aspect dereţea de canalicule în celulele nervoase sau aspect de dictiozomi (discuri în fişic) în celulele embrionare, celulele vegetale, celulele seminale şi celulele unor nevertebrate. Excepţie fac hematiile în care organitul lipseşte şi celulele musculare în care are un aspect rudimentar.
La microscopul electronic , complexul Golgi ia aspect de cavităţi cu diametrul de 60-90 Å şi conţinut bogat în hidrolaze, ce pot lua diferite forme:
- de tubuli sau saci golgieni suprapuşi , paraleli, uneori plani sau uşori încurbaţi; între saci sunt intervale de 60-200 Å, iar lumenul sacilor măsoară circa 60-70 Å, fiind în număr de 3-10, mai mulţi în celulele secretorii; sacii prezintă o anumită polaritate, demonstrată de G.E. Palade, având o faţă concavă sau trans (distală) numită de maturare, orientată spre plasmalemă şi o faţă convexă sau cis (proximală) orientată spre nucleu şi REG, cu rol de formare şi de sinteză a glucidelor;
- de microvezicule sau vezicule de transfer cu aspect de cavităţi sferoidale , eliptice cu diametru de 300-500 Å, aflate în citoplasma dintre reticulul endoplasmatic granular şi sacii golgieni; microveziculele îşi au originea din tubulii REG şi au rolul de a transporta substanţe de la nivelul reticulului spre sacii golgieni;
- de macrovezicule de secreţie cu aspect de cavităţi sferoidale sau ovoide , cu diametru de 2.000-6.000 Å, ce se desprind din partea periferică rotunjită a ultimilor saci golgieni, au un conţinut fluid, dens la maturare şi rol de a vehicula spre plasmalemă produşii formaţi.
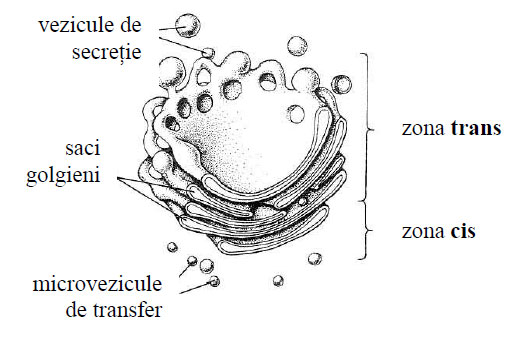
Figura 47 - Aspecte schitate ale complexului Golgi (după Darnell et al., 1988)
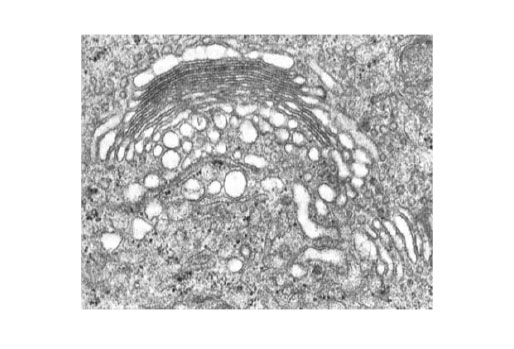
Figura 48 - Complexul Golgi pe secţiune de vas deferent de şobolan, 65.000x (după Bloom et al., 1975)
Compoziţia chimică
Organitul conţine glucide, proteine, fosfolipide, protein-enzime, substanţe minerale, apă. În zona trans s-au pus în evidenţă acid ascorbic, lipoproteine, mucoproteine ş.a., iar la nivelul membranei sacilor golgieni glicozil-tranferaze.
Originea aparatului Golgi este explicată prin ipotezele de formare din membranele reticulului endoplasmatic, din plasmalemă sau din învelişul nuclear.
Funcţiile complexului Golgi
Funcţia de condensare şi agregare a proteinelor presupune ca precursorii proteici sintetizaţi în ribozomii ataşaţi membranelor REG să fie transportaţi spre sacii golgieni prin microveziculele de transfer, iar în saci va avea loc condensarea, maturarea lor şi formarea unor proteine specifice.
Funcţia de sinteză şi de secreţie a poliglucidelor are loc în zona trans a sacilor golgieni. Poate fi pusă în evidenţă prin histoautoradiografie utilizând ca precursor glucoza marcată.
Funcţia de complexare, definitivare şi de formare a unor produşi de secreţie poate fi demonstrată prin electronomicroscopie şi histoautoradiografie, când se observă că sacii centrali dintr-un pachet se transformă în granule de mucus, din care se vor forma saci noi periferici cu rol în definitivarea unor mucopoliglucide, mucoproteine şi glicoproteine.
Funcţia neurosecretorie s-a demonstrat prin electrono-microscopie pe diferite tipuri de neuroni, la care s-au observat granule de secreţie dense la fluxul de electroni în zona organitului.
Funcţia de angajare în unele procese patologice , când organitul a fost considerat ca loc de origine în formarea granulelor de melanină în stări tumorale, iar în inflamaţii s-a observat o hiperproducţie de microvezicule.
Mitocondria
Etimologie: mitos gr.= fir, aţă; chondrion gr.= granulă
Mitocondriile au fost observate şi evidenţiate de către Robert Altmann [1890] şi Albert von Kolliker prin coloraţie specifică vitală cu verde Janus-B.
În 1897, Karl Benda a confirmat existenţa organitului prin coloraţie specifică cu hematoxilină ferică.
Mitocondriile sunt organite specializate în producerea energiei necesară activităţilor celulei eucariote, fiind adevărate ’’centrale energetice” în care energia eliberată prin oxidarea unor substanţe este convertită în ATP prin procesul de fosforilare oxidativă. Ele se găsesc în aproape toate celulele eucariote vegetale, animale şi umane, excepţie făcând hematiile, în care lipsesc.
Celulele vegetale mai au şi alte organite, numite cloroplaste ce captează energia luminoasă şi o transformă în ATP prin procesul de fotosinteză.
Localizarea în celulă a mitocondriilor este în funcţie de necesarul de ATP.
Morfologia mitocondriilor
La microscopul optic mitocondriile au fost observate sub formă de granule şi filamente, ulterior sugerându-se că organitele ar fi sediul respiraţiei celulare, adică sediul utilizării oxigenului în celulă. Abia după 1950 s-a putut preciza ultrastructura mitocondriilor cu ajutorul microscopului electronic. Compoziţia chimică, organizarea moleculară şi funcţiile mitocondriilor au putut fi studiate numai după izolarea lor prin ultracentrifugare diferenţială, realizată de Hogeboom, Schneider şi Palade în 1948. In 1952, Palade şi Sjostrand, independent unul de celălalt, au elucidat ultrastructura mitocondriei, pe secţiuni de ficat.
Dimensiunile mitocondriilor sunt de circa 0,3-2 pm până la 10-12 pm în celulele secretoare din acinii pancreatici, iar în ovocitele de broască Rana pipiens sp. pot ajunge până la circa 20-40 pm.
Numărul mitocondriilor este variabil, în funcţie de gradul de diferenţiere celulară şi de intensitate metabolică. Algele unicelulare au câte o mitocondrie, în hematii lipsesc, în spermatozoid sunt 20-24 de mitocondrii, în celulele renale circa 300, în hepatocite circa 1.000, iar în Amoeba sp. sunt până la 500.000 de mitocondrii.
Forma mitocondriilor în celulele vii, studiate la microscopul în contrast de fază sau filmate, este foarte variată, ele fiind în general alungite. Forma lor este dependentă de procesele metabolice petrecute în celulă.
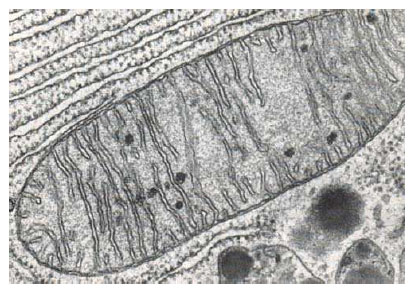
Figura 49 - Mitocondrie în celulă pancreatică de liliac, TEM 79.000x (după Bloom et al., 1975)
Ultrastructura mitocondriei
La microscopul electronic mitocondria are aspectul unei cavităţi ovoidale sau sferice, mărginită de o membrană externă cu grosimea de 60 Å, netedă şi continuă, care se poate deforma prin invaginare datorită curenţilor citoplasmatici. Membrana externă conţine enzime ce uşurează trecerea aminoacizilor şi a acizilor graşi din citosol spre mitocondrie (coenzima A-ligaza, monoaminoxidaza -enzimă marker etc.).
Membrana internă a mitocondriei urmăreşte în general conturul membranei externe, prezentând din loc în loc nişte invaginări sau pliuri de forme variate, numite criste mitocondriale, cu aspect de lame sau de tubuli. Membrana internă mitocondrială prezintă pe toată lungimea ei, inclusiv pe criste, subunităţi implicate în reacţiile enzimatice funcţionale specifice, numite particule elementare sau oxizomi. Aceste particule elementare conţin enzimele lanţului respirator şi ale fosforilării oxidative.
Prin membrana internă mitocondrială trec spre spaţiul intern ioni, în special cei de calciu şi magneziu, necesari activării enzimelor din matricea mitocondrială, mai trec molecule de ADP şi ATP necesare desfăşurării procesului de fosforilare activă, acizi graşi şi o serie de aminoacizi cum ar fi glutamatul şi aspartatul, vehiculaţi cu proteine cărăuşi sau translocatori (translocaze, permeaze).
Intre cele două membrane ale mitocondriei se află un spaţiu numit spaţiu perimitocondrial sau inter-membranar de circa 60-80 Å, electrono-transparent, ce se prelungeşte şi în cristele mitocondriale.
Cristele pot fi orientate perpendicular sau paralel cu axul longitudinal al organitului, pot fi rectilinii, ramificate, încrucişate în reţea, compartimentând o matrice fluidă numită matrice mitocondrială.
Matricea mitocondrială este în general omogenă, fiind formată din proteine structurale şi contractile, ce contribuie la realizarea funcţiilor organitului, precum şi protein-enzime în număr ridicat (circa 200). Dintre enzime cele mai importante sunt enzimele oxido-reducătoare ale ciclului Krebs ca: fumaraza, malatdehidrogenaza (MDH), izocitratdehidrogenaza (DH), citratsintetaza, aconitaza ş.a.
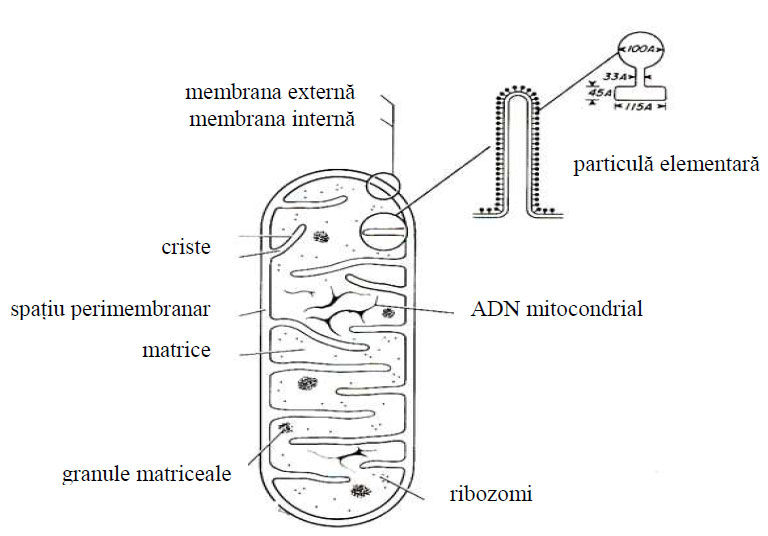
Figura 50 - Reprezentare schematică a componentelor structurale din mitocondrie (după Bloom et al, 1975)
Mitocondria suferă o serie de modificări fiziologice ciclice, cu aspect de umflare sau de condensare, datorate mecanismului prin care energia chimică este transformată în energie mecanică.
În timpul mitozei, mitocondria se fragmentează la cele două celule-fiice, iar în momentul reconstituirii învelişului nuclear fragmentele se reunesc şi mitocondria îşi reia aspectul normal.
Compoziţia chimică a mitocondriei este de circa 70% proteine, 20% lipide, 0,5% acizi nucleici, ioni, vitamine şi apă. Membrana externă conţine circa 60% proteine şi 40% lipide din care predomină colesterolul, iar cea internă conţine 80% proteine şi 20% lipide fără colesterol, dar conţine cardiolipin în concentraţie mai mare faţă de membrana externă. Acesta face ca membrana internă să fie mai puţin permeabilă, constituind un fel de barieră între matricea mitocondrială şi restul organitului.
Matricea mitocondrială are o structură filamentoasă, conţinând proteine, acizi nucleici, apă, ioni de calciu, magneziu, potasiu, clor şi nişte granule osmiofilice, numite ribozomi mitocondriali. Moleculele de ADN din matricea mitocondrială, ca şi proteinele ribozomale din granule sunt diferite structural de cele aflate în nucleu.
Replicarea moleculei de ADN mitocondrial nu este sincronă cu replicarea ADN-ului nuclear, nu este continuă, ci este mai lentă şi independentă de aceasta.
În anul 1957 Chevremont, prin ultracentrifugare diferenţială şi prin histoautoradiografie, a pus în evidenţă ADN-ul mitocondrial, cu aspect circular la protozoare, moluşte, levuri, peşti şi mamifere. ARN-ul mitocondrial este format în matrice sub controlul direct al ADN-ului şi are rol în controlul genezei membranei mitocondriale.
Mitocondria stabileşte raporturi cu nucleul celulei prin puncte de contact, când la scurte intervale de timp au loc schimburi de substanţe la acest nivel, cu reticulul endoplasmatic neted ai cărui tubuli înconjoară mitocondriile, cu centrozomul şi cu plasmalema.
Originea mitocondriei este explicată prin mai multe ipoteze, prin care mitocondria ar prezenta o autonomie genetică parţială datorită acizilor nucleici din matricea ei, astfel că ea se poate auto-regenera fie prin formare de mitocondrii noi, fie prin clivaj sau înmugurire din mitocondrii deja existente, fie prin formare din alte citomembrane (înveliş nuclear, membranele complexului Golgi, plasmalemă).
Funcţiile mitocondriei
Mitocondria este principalul furnizor de energie necesară activităţilor celulare, este consideratăsediul respiraţiei celulare şi sediul unor enzime, ioni şi al sintezei de hormoni steroizi (în celulele glandelor suprarenale).
În stări patologice, cum ar fi ischemia, se observă fragilitatea organitului prin ruperea citomembranelor şi scăderea densităţii matricei mitocondriale, în stări de inaniţie scade numărul mitocondriilor şi cel al cristelor, iar la indivizii cu epilepsie mitocondriile iau aspectul de umflare permanentă.
Prin tehnici de inginerie genetică, s-a constatat că genele mitocondriale provin numai de la mamă, cu importanţă îndiagnosticarea timpurie a unor boli genetice (boala Leber) şi în stabilirea filogenetică a descendenţilor Evei.
Lizozomii
Etimologie: lysis gr.= dizolvare, distrucţie; soma gr.= corp, corpuscul
Sunt organite permanente implicate în digestia celulară . Au fost descoperiţi în 1951 de către Christian de Duve şi Jaques Berthet, în omogenatele de ficat şi de rinichi, care prin ultracentrifugare diferenţială au sedimentat în fracţiuni bogate în hidrolaze.
În 1954 la microscopul electronic, Starus a confirmat existenţa lizozomilor în celule, iar în 1956 Nikolai Novikoff le-a descris organizarea ultrastructurală.
Localizarea lizozomilor
În cele mai variate tipuri de celule lizozomii apar în citoplasma periferică sau uneori concentraţi în zona sacilor golgieni. Excepţie fac hematiile în care lizozomii lipsesc.
Morfologia lizozomilor
Lizozomii sunt cavităţi sferice sau ovoidale, mărginite de membrane, cu dimensiuni medii de 0,25-0,8 chiar de 1,5 pm.
Structura şi ultrastructura lizozomilor
Iniţial, lizozomului i s-a descris o membrană unică trilaminată lipoproteică de circa 80 Å grosime, dar în 1957 Maunsbach a descris lizozomi cu membrană dublă în nefrocite. Între membrana şi matricea lizozomală există un spaţiu liber numit halou.
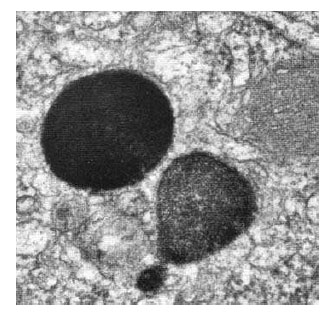
Figura 51 - Lizozomi din celule din vas deferent de sobolan, 65.000x (după Bloom et al., 1975)
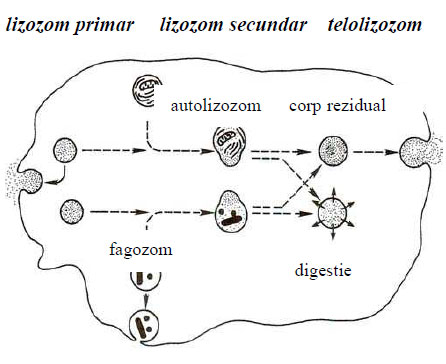
Figura 52 - Tipuri de lizozomi (după Johnson, 1991)
Compoziţia chimică a lizozomilor
Matricea lizozomală este neomogenă şi conţine între 40-50 de enzime hidrolazice ce pot degrada practic orice componentă a celulei. De exemplu, acizii nucleici sunt degradaţi prin ribonucleaza acidă şidezoxiribonucleaza acidă, esterii fosforici sunt degradaţi prin fosfataza acidă ca enzimă marker lizozomală, proteinele sunt degradate prin colagenaze, catepsine B, C şiD, glicogenul prin a-glicozidază, mucopoliglucidele prin a- manozidază, P-galactozidază şi P-glucuronidază, iar lipidele prin sfingomielinaze ş.a.
Cea mai mare parte a enzimelor sunt localizate în matricea lizozomală, altele sunt pe membrana organitului, iar restul apar şi în matrice şi pe membrană. Fosfataza acidă şi arilsulfataza sunt considerate enzime marker pentru identificarea lizozomilor.
Matricea lizozomală mai conţine proteine, fosfolipide, glicolipide, flavine, acid hialuronic, electroliţi şi apă.
În mod normal, enzimele lizozomale nu sunt active, deoarece s-ar produce distrugerea necontrolată a conţinutului celular. Latenţa enzimelor se datorează integrităţii şi impermeabilităţii membranei lizozomale, care ori de câte ori este afectată, se produce pierderea latenţei enzimelor lizozomale, adică activarea lor, dar numai la un pH acid de 4-6.
Formarea lizozomilor
Enzimele lizozomale sunt sintetizate în ribozomii ataşaţi REG, se acumulează în lumenul acestuia de unde vor fi transportate prin microvezicule de transfer către zona Golgi. În zona cis golgiană (primii 2 saci), pentru segregarea specifică a enzimelor lizozomale esenţială este prezenţa unui rest de manoză-6-fosfat, recunoscută de un receptor specific din membrana sacilor golgieni.
În funcţie de aspectul electronomicroscopic şi de compoziţia chimică, lizozomii se împart în trei categorii:
- lizozomii primari cu matrice nestructurată, ce conţin seturi incomplete de enzime hidrolazice, au dimensiuni mici, sunt consideraţi lizozomi tineri cu durată de viaţă mai scurtă, de circa 24-48 de ore;
- lizozomi secundari cu matrice structurată, ce conţin pe lângă enzimele hidrolazice şi alte componente biochimice, chiar particule endocitate de celulă, au dimensiuni mai mari şi durată de viaţă mai lungă, de la câteva zile la câteva săptămâni;
- lizozomi reziduali (corpi reziduali sau telolizozomi) fără conţinut enzimatic, numai cu resturi de substanţe nedigerate, granule de lipofuscină şi de hemosiderină, ce apar sub formă lamelară sau de incluzii omogene, numite corpi reziduali.
Funcţiile lizozomilor
Lizozomii sunt implicaţi în procesele de digestie intracelulară normală şi patologică, prin conţinutul lor hidrolazic. Datorită enzimelor proprii, ei transformă substanţele macromoleculare preluate prin aport endocitar, ca şi propriile molecule în componente de bază necesare metabolismului celular.
Lizozomii participă la procesele de apărare prin digestia microorganismelor ajunse în celulă. Ei sunt principalele organite ale macrofagelor, leucocitelor polimorfonucleare, monocitelor, adică ale celulelor specializate în funcţia de apărare a organismului.
Lizozomii participă la procesele de auto-regenerare tisulară, adică celulele degenerate şi îmbătrânite, care nu mai pot îndeplini funcţii, sunt supuse unui proces de autoliză realizată de lizozomii proprii, proces prin care practic celulele se autodistrug. Acest proces este repetat, dar în proporţii mai mici, când se produce auto-regenerarea unor componente sau organite celulare uzate.
În boala numită mucopolipidoza II enzimele lizozomale nu posedă semnalul de recunoaştere tip manoză-6-fosfat, astfel că enzimele lizozomale sintetizate în cantitate normală sunt eliberate în spaţiul extracelular, de unde nu mai pot fi recaptate.
Alte defecte în funcţia lizozomilor sunt caracterizate de lipsa uneia sau a mai multor enzime lizozomale, în boli genetice numite tezaurismoze lizozomale, când în lizozomi se acumulează lipide sau poliglucide nedigerate, compromiţând funcţia lor în celulă şi a celulei în organism. În aceste cazuri cele mai afectate organe sunt creierul, ficatul şi splina, iar acumularea produşilor de stocare este lentă.
Exemple de tezaurismoze lizozomale de depozit sunt maladia Gaucher cu absenţa glicocerebrozidazei, maladia Nieman-Pick cu absenţa sfingomielinazei, maladia Tay-Sachs cu lipsa acetilhexozaminidazei, leucodistrofia metacromatică cu lipsa arilsulfatazei, maladia Pompe cu lipsa enzimelor glicogenolitice, boli care au fost descrise clinic chiar înainte de a se descoperi lizozomii.
Mecanismele digestiei celulare
Digestia localizată
Digestia localizată este un proces care se desfăşoară atunci când conţinutul enzimatic lizozomal este eliberat în diferite compartimente ale aparatului vacuolar, adică în fagozomi, autozomi etc. În funcţie de natura materialului conţinut în aparatul vacuolar, digestia localizată poate fi sub formă de heterofagie şi autofagie.
Heterofaeia
Heterofaeia se realizează prin digestia cu ajutorul lizozomilor a substanţelor exogene, a substanţelor nutritive, a bacteriilor sau a virusurilor, înglobate în celulă prin endocitoză în vacuole specifice, numite fagozomi sau pinozomi. Procesul de heterofagie este legat de nutriţia celulei şi de mecanismele ei de apărare.
Fagozomii sau pinozomii sunt antrenaţi prin mişcările citoplasmatice către interiorul celulei, unde se apropie de lizozomii primari cu care fuzionează într-o singură vacuolă numită fagolizozom sau lizozom secundar, în interiorul căruia enzimele hidrolazice încep procesul de digestie a produsul înglobat, proces a cărui durată este diferită în funcţie de complexitatea materialului endocitat.
În urma acţiunii enzimatice, se obţin molecule mici de proteine, hidraţi de carbon şi lipide, care vor traversa membrana fagolizozomului, fiind puse la dispoziţia celulei pentru refacerea componentelor citoplasmatice.
Autofagia
Autofagia este procesul de digestie intra-citoplasmatică cu ajutorul enzimelor lizozomale a organitelor din celula respectivă, care şi-au terminat activitatea şi se află în diferite grade de degenerare şi dezintegrare. În felul acesta, lizozomii intervin în procesul de reînnoire (turnover) a componentelor din celula normală.
În jurul organitelor sau a porţiunilor de organite degradate, citosolul elaborează o endomembrană delimitantă pentru a le separa de restul celulei. În felul acesta se realizează o vacuolă numită autofagozom, care se va uni cu lizozomul primar formând o vacuolă unică numită autofagolizozom. În interiorul acestei vacuole, enzimele lizozomale descompun materialul organic în molecule mici de proteine, lipide sau glucide, care vor fi puse la dispoziţia celulei pentru edificarea de noi structuri.
Figura 53 - Schită reprezentând rolul lizozomilor în heterofagie si autofagie (după Bloom et al., 1975)
Crinofagia
Crinofagia este un caz particular de autofagie ce se observă în celulele secretorii exocrine şi endocrine, în care în unele faze de hiperactivitate celulară se acumulează un surplus de vezicule secretorii ce nu mai ajung să fie exocitate. Surplusul secretat va fi digerat cu ajutorul enzimelor lizozomilor primari, cu care veziculele secretorii fuzionează într-o vacuolă unică autofagolizozomală. Prin crinofagie, moleculele mici rezultate trec în citosol, unde vor suferi procese noi de reutilizare.
Din digestia materialului exogen în fagolizozomi sau a materialului endogen în autolizozomi pot rămâne resturi nedigerabile, care se acumulează şi transformă vacuolele respective în corpi reziduali sau telolizozomi. Aceştia reprezintă etapa finală în procesul digestiei intracelulare, corpii reziduali derivând din lizozomii secundari heterofagi sau autofagi.
Corpii reziduali au talie mare, sunt delimitaţi de membrană şi prezintă o matrice heterogenă, în care apar resturi mielinice, pigmenţi sau granule de diferite dimensiuni. La nivelul lor, hidrolazele acide sunt foarte reduse cantitativ sau chiar pot lipsi.
Corpii reziduali sunt eliminaţi în cea mai mare parte în exteriorul celulei prin procesul de exocitoză. În unele celule însă, ei pot fi depozitaţi în citosol până la moartea celulei respective sau pot constitui elemente de stabilire a gradului de degenerescenţă celulară.
Autoliza
Autoliza este un proces de autodigestie, ce se poate realiza pe suprafeţe mari, producând modificări degenerative ale celulei în cauză, care se finalizează prin moarte celulară sau se poate realiza pe suprafeţe limitate, procesele fiind reversibile, fără moartea celulei.
Autoliza este provocată de distrugerea membranei lizozomale, urmată de eliberarea enzimelor hidrolazice în citosol. Procesul se poate limita la un număr redus de lizozomi, când autoliza este limitată sau se poate produce pentru un număr mare de lizozomi, când autoliza este generalizată, cu procese degenerative ireversibile.
Autoliza se poate desfăşura în condiţii fiziologice normale , când are loc îndepărtarea celulelor uzate şi îmbătrânite, urmată de apariţia unor celule noi, tinere, adică regenerarea ţesutului respectiv. În cazul diviziunilor celulare are loc o autoliză limitată pe durata profazei, cu autoliza învelişului nuclear, şi a telofazei cu autoliza fusului de diviziune.
În condiţii patologice, autoliza este totală. Astfel, membranele lizozomale pot fi distruse de substanţe medicamentoase, toxine bacteriene sau de perturbări ale metabolismului celular. În cazul în care se distruge membrana celulară, iar conţinutul lizozomilor se eliberează în spaţiul extracelular, se produce o autoliză pe suprafeţe întinse de ţesut, adică necrozarea.
Prin degradarea antigenelor pătrunse în celulă, lizozomii joacă un rol important în procesele imunologice, pentru că pun la dispoziţia celulei competente imunologic informaţiile necesare în procesul de autoapărare.
Proteazomii
Sunt structuri formate din complexe proteice mari ce se găsesc în toate celulele eucariote, localizaţi atât în nucleu cât şi în citoplasmă, precum şi în unele bacterii. Proteazomii sunt parte componentă majoră într-un mecanism prin care celulele îşi reglează concentraţia unor proteine speciale şi le degradează pe cele defecte. Proteinele defecte sunt marcate pentru degradare de o proteină, numită ubiquitină.
Importanţa degradării proteolitice din celule şi rolul ubiquitinei în procesul proteolitic au fost recunoscute în 2004 prin acordarea premiului Nobel în Chimie cercetătorilor Aaron Ciechanover, Avram Hershko şi Irwin Rose.
Morfologie şi structură
Dimensiunea proteazomului este relativ constantă, fiind de circa 150/115 Å. Ca structură, proteazomul este un complex mare în formă de butoi ce conţine un „miez" din 4 inele stivuite în jurul unui por central. Inele interioare formează o cavitate de 53 Å în lărgime, cu toate că intrarea ei este îngustă de doar 13 Å, sugerându-se astfel că proteinele-substrat ar trebui să fie parţial desfăcute pentru a putea intra.

Figura 54 - Proteazom, vizualizare longitudinală şi transversală (după Thomas Splettstoesser, PyMol DeLano Scientific LLC)
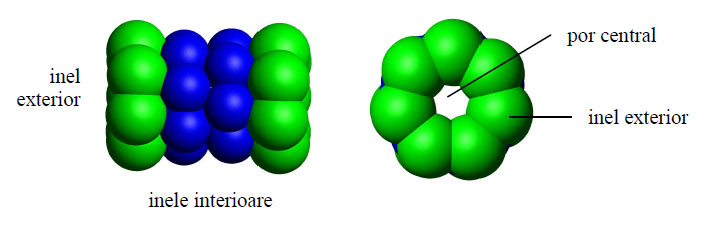
Figura 55 - Proteazom 20S, model 3D (ansamblu şi transversal) (după Thomas Splettstoesser, PyMol DeLano Scientific LLC)
Funcţiile proteazomilor
Calea de degradare proteazomală este esenţială pentru multe procese celulare, ce includ ciclul celular, reglarea expresiei genelor, răspunsurile la stress-ul oxidativ, la infecţie, la şocul termic, reglarea creşterii plantelor, în apoptoză.
Activitatea incompletă a proteazomilor a sugeratexplicarea unor boli neuro-degenerative, cum ar fi boala Parkinson şi boala Alzheimer, ce implică agregarea de proteine insolubile defectuos sintetizate, ce eliberează neurotoxine printr-un mecanism ce încă nu este bine cunoscut.
Proteazomii mai joacă un rol deschis în funcţia sistemului imun adaptativ.
S-a demonstrat că inhibitorii proteazomilor au activitate efectiv anti- tumorală în celulele in vitro, inducând apoptoza prin întreruperea degradării regulate a proteinelor ciclului celular de creştere.
Complexul exozom
Începând cu anul 1997, numeroşi cercetători şi-au îndreptat atenţia spre un complex multi-proteinic implicat în degradarea diferitelor tipuri de ARN, ce a fost ulterior denumit complexul exozom. El este prezent atât în celulele procariote cât şi în cele eucariote, la bacterii având o structură moleculară mai simplă, cu aceleaşi funcţii, dar numindu-se degradozom.
Obţinerea de complexe exozomi din celulele eucariote a fost posibilă abia în anul 2001 (Brouwer et al., Chen et al.).
Complexul exozom este un component celular ce nu poate fi evidenţiat prin metodele actuale de microscopie, fiind mai degrabă un component biochimic ce poate fi izolat şi analizat doar prin procedee biochimice şi biofizice.
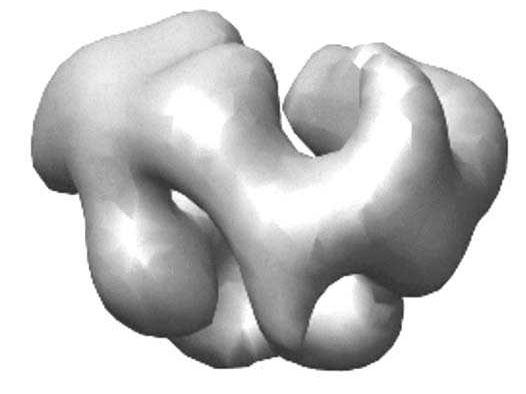
Figura 56 - Exozom, model 3D
În celulele eucariote, complexul exozom se află în citoplasmă, nucleu şi mai ales în nucleol. El este alcătuit din 6 protein-enzime din clasa ribonucleazelor, dispuse în formă de inel. Peste acest agregat molecular de formă inelară se suprapun alte trei proteine globulare, numite proteine S-1, în felul acesta cele 9 proteine vor constitui o structură cristaloidă ce reprezintă miezul complexului exozom.
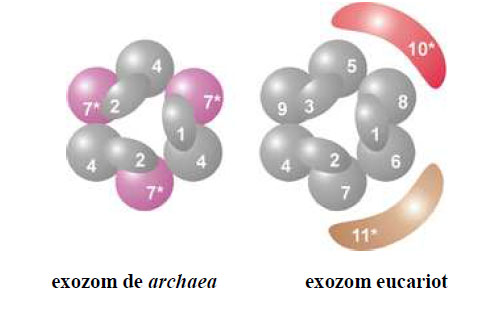
Figura 57 - Organizarea subunităţilor complexului exozom: la archaea apar 4 proteine diferite, iar la eucariote 9 proteine diferite
Acestuia i se adaugă 2 proteine asociate, prima notată Rrp44 şi a doua notată PMScl-100, ambele fiind ribonucleaze hidrolitice implicate în scindarea legăturilor nucleotidelor doar în prezenţa apei. În afară de aceste două categorii de proteine (proteinele miezului exozomului şi cele asociate lui) mai există numeroase alte proteine din citoplasmă sau nucleu ce pot interacţiona cu complexul exozom influenţându-i activitatea, drept pentru care sunt numite proteine reglatorii.
Atât proteinele miezului complexului exozom, cât şi proteinele asociate sunt proteine esenţiale. Dacă expresia lor este oprită în mod artificial, creşterea celulară încetează şi survine moartea celulei.
Funcţiile complexului exozom
Funcţia complexului exozom este, în principal, enzimatică. Aşa cum s-a menţionat, proteinele miezului complexului exozom aparţin clasei ribonucleazelor, ele fiind implicate în procesarea ARN-mesager şi a ARN- ribozomal.
Acţiunea complexului exozom asupra ARN este atât exoribonucleolitică (degradarea ARN fiind efectuată de la un capăt al moleculei), dar şi endonucleolitică (clivajul ARN fiind efectuat în interiorul moleculei).
Prin aceasta, complexul exozom efectuează controlul celular al cantităţii de ARN, recunoscând şi degradând complexele proteine-ARN neprocesate, greşit procesate sau instabile încă înainte de ieşirea lor din nucleu.
Implicaţii medicale. Se ştie în prezent faptul că în boli autoimune ca sclerodermia, polimiozita sau dermatomiozita, auto-anticorpii sunt direcţionaţi împotriva proteinelor complexului exozom, blocându-le astfel activitatea.
Inhibarea complexului exozom poate fi realizată, în tratarea unor tumori solide, cu ajutorul unui medicament antimetabolit, numit fluoruracil.
Exozomii vezicule
Complexul exozom nu trebuie confundat cu exozomii vezicule, care sunt structuri delimitate de citomembrane, cu diametrul de 50-90 nm, prezente într-un mare număr de celule de mamifere, fiind foarte numeroşi în celulele din sistemul imun (celulele dendritice sau celulele B).
Exozomii vezicule au fost observaţi pentru prima dată în eritrocitele imature, numite reticulocite. Natura proteinelor din aceşti exozomi vezicule variază în relaţie cu celula în care s-au format, dar proteina lor marker este considerată exocarta-databaza.
Exozomii vezicule se formează dintr-o invaginare a membranei celulare (plasmalema), vezicula rezultată, numită endozom, fiind endocitată şi fragmentată într-un număr de microvezicule care, după ce vor fi expulzate din celulă, se vor numi exozomi vezicule. Membrana lipoproteică ce le delimitează conţine liganzii comuni ai plasmalemei din care provine.
Exozomii formaţi în condiţii normale sau patologice conţin, pe lângă aproximativ 31 de proteine diferite, ARNm şi tipuri de ARN funcţionali, care pot fi transferaţi dintr-o celulă în alta, influenţând sinteza de proteine în celula receptoare. Acest ARN a fost numit ARN-navetist exozomal.
Implicaţii medicale. Exozomii vezicule derivaţi din celulele dendritice ale sistemului imun exprimă antigenii MHC I şi MHC II (antigenii histocompatibi-lităţii majore) şi intervin în declanşarea răspunsului specific al celulelor T.
Analiza exozomilor aflaţi ca microvezicule în urină este utilizată îndiagnosticul cancerului prostatei, iar a celor din sânge în diagnosticul unor tumori solide cu diverse localizări. Analiza ARN din exozomii circulanţi este folosită pentruevidenţierea mutaţiei ce a indus malignizarea.
Peroxizomii
Peroxizomii sunt organite celulare cu capacitate de a produce şi de a descompune peroxidul de hidrogen (apa oxigenată). Peroxizomii sunt organite prezente în citosolul celulelor animale, vegetale şi umane.
În 1954 au fost observaţi la microscopul electronic de către J. Rhodin, în celulele tubilor contorţi proximali din rinichi, ca nişte structuri subcelulare pe care le-a numit ”microbodies”. Ulterior, conceptul de peroxizomi ca organite distincte a fost dezvoltat de Christian de Duve şi colaboratorii săi, prin studii de fracţionare a celulei hepatice, când s-a pus în evidenţă o fracţiune subcelulară având ca enzime-markeri : uratoxidaza, catalaza şi D-amino- acidoxidaza.
Numărul peroxizomilor diferă de la un tip celular la altul, iar în aceeaşi celulă variază în funcţie de momentul ei metabolic. În multe celule, chiar şi în cea hepatică, numărul peroxizomilor poate fi mai mare decât cel al lizozomilor.
Formă şi dimensiuni. Peroxizomii au formă sferică sau ovală, uneori cu contur neregulat cu prelungiri, cu diametrul de 0,5-1,5 pm pentru macroperoxizomi şi de 0,1-0,4 pm pentru microperoxizomi.
Ultrastructura peroxizomilor. La exterior peroxizomii sunt delimitaţi de o membrană unică trilaminată, cu o grosime de 65-80 Å, permeabilă pentru ioni şi molecule mici. Membrana peroxizomală are o compoziţie asemănătoare cu a membranei RE, dar diferă de aceasta prin unele polipeptide şi enzime structurale.
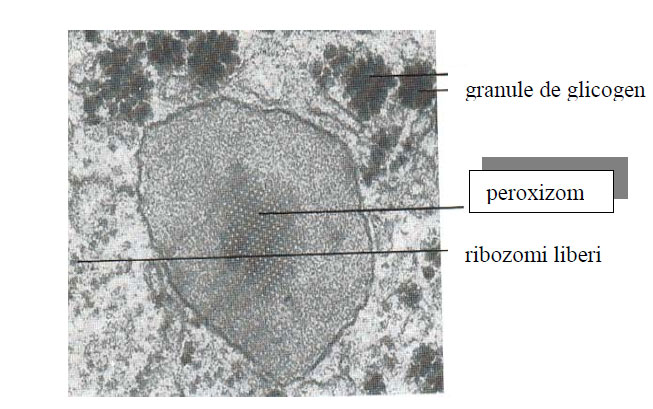
Figura 58 - Peroxizom, TEM 186.000x (după Loewy et al., 1974)
La interior peroxizomul prezintă o matrice densă, fin granulată. În unele celule, matricea are o zonă centrală, numită miez ocupată de un cristaloid cu structură ordonată, format din mănunchiuri paralele de tubuli denşi la fluxul de electroni.
Origine. Peroxizomii pot lua naştere mai rar, direct din RE, prin dilatarea şi desprinderea anumitor părţi terminale ale cisternelor acestuia, cu reacţie pozitivă pentru catalază. Mai des însă, peroxizomii se formează prin conlucrarea dintre RE şi complexul Golgi, nefiind încă precizat mecanismul molecular prin care proteinele peroxizomale pătrund în organit. Se pare că unele enzime (catalaza şi uratoxidaza) sunt direcţionate către peroxizom direct prin citosol din ribozomii liberi, iar altele din REG.
Compoziţia chimică. Peroxizomii conţin proteine, lipide şi enzime speciale, cum ar fi catalaza ca marker peroxizomal (reprezintă 33% din protein-enzimele peroxizomului), uratoxidaza (uricaza), D-aminoacidoxidaza, enzimele ciclului glioxilat ş.a.
Funcţiile peroxizomilor
Peroxizomii intervin în metabolismul peroxidului de hidrogen în două etape. În prima etapă, prin acţiunea oxidazelor se produce peroxidul de hidrogen din D şi L-aminoacid, acid lactic şi alte substanţe. În a doua etapă, catalaza desface peroxidul de hidrogen, care este toxic pentru celulă în molecule de oxigen şi apă. În acest fel are loc oxidarea alcoolilor, a fenolilor, a acidului formic şi a formaldehidei, manifestându-se rolul de detoxificator al diferitelor molecule ajunse în celulă.
Prin acţiunea uratoxidazei, peroxizomii sunt implicaţi îndegradarea purinelor (adenina şi guanina) şi prin aceasta în metabolismul acizilor nucleici.
Peroxizomii conţin un sistem enzimatic activ pentru beta-oxidarea acizilor graşi, fapt dovedit şi în celulele animale. Peroxizomii împart această funcţie cu mitocondriile, fiind însă mai puţin activi. S-a observat că procesul beta-oxidării peroxizomale se desfăşoară la un nivel crescut în celulele ficatului după o dietă bogată în lipide. Peroxizomii pot activa şi oxidarea acizilor graşi, cum ar fi palmitatul şi laureatul, intervin în biosinteza glicerolipidelor prin dihidro-acetono-fosfatacil-transferaza prezentă în ei.
Se presupune că peroxizomii ar avea şi rol în termogeneză producând căldură prin adaptare la frig, fiind în număr mare în celulele ţesutului adipos brun.
Implicaţii medicale
Se cunosc două boli peroxizomale congenitale, acatalesemia, prin care la indivizii afectaţi se observă lipsa catalazei în peroxizomi încă de la naştere, şi sindromul cerebro-hepato-renal Zellweger, prin care indivizii afectaţi au număr redus de peroxizomi în celule şi un conţinut enzimatic alterat.
Hipertiroidia determină o proliferare hepatică a peroxizomilor cu creşterea accentuată a activităţii catalazei şi a beta-oxidării acizilor graşi cu lanţ lung.
În adrenoleucodistrofii, ca maladii genetice letale, caracterizate prin distrugerea progresivă a substanţei albe din creier şi a corticosuprarenalei, s-a descris o diminuare a funcţiei peroxizomilor de oxidare a acizilor graşi cu lanţ lung de atomi de carbon.
Christian de Duve a atras atenţia asupra relaţiei dintre peroxizomi şi cancer, afirmând că una dintre cele mai constante trăsături biochimice ale tumorilor canceroase este activitatea catalazică scăzută în celulele hepatice la animalele cu tumori. El a observat că peroxizomii pot fi încă identificaţi în tumorile cu creştere lentă, dar ei lipsesc total în tumorile cu creştere rapidă.