Mitocondriile
- Detalii
- Categorie: Biologie celulară
- Accesări: 1,623
Viața, în esența sa, este un proces energetic continuu. De la cea mai simplă celulă până la organismele complexe precum omul, toate formele de viață necesită energie pentru a funcționa, pentru a se dezvolta și pentru a supraviețui. În interiorul fiecărei celule eucariote, există structuri microscopice fascinante care reprezintă cheia acestui proces vital - mitocondriile.
Supranumite adesea "centralele energetice" ale celulelor, mitocondriile sunt mult mai mult decât simple producătoare de energie. Aceste organite complexe sunt implicate în reglarea morții celulare programate, în metabolismul calciului, în semnalizarea celulară și în numeroase căi metabolice esențiale. Evoluția lor pe parcursul a miliarde de ani, de la bacterii libere la componentele indispensabile ale celulelor noastre, reprezintă una dintre cele mai remarcabile povești ale istoriei vieții pe Pământ.
În ultimele decenii, cercetările au dezvăluit roluri tot mai complexe ale mitocondriilor în sănătate și boală. Disfuncțiile mitocondriale sunt acum recunoscute ca factori majori în afecțiuni diverse, de la boli neurodegenerative și cancer până la diabetul zaharat și procesul de îmbătrânire. Înțelegerea acestor mecanisme oferă oportunități fără precedent pentru dezvoltarea unor abordări terapeutice inovatoare.
Acest articol explorează universul fascinant al mitocondriilor - de la structura lor complexă și mecanismele de replicare până la rolurile lor multiple în funcționarea celulară normală și în patologie. Descoperirea acestor organite remarcabile continuă să deschidă noi perspective asupra fundamentelor biologice ale vieții și să inspire direcții promițătoare în medicină și biotehnologie.
Ce sunt mitocondriile?
Mitocondriile sunt organite celulare cu un rol crucial în majoritatea celulelor eucariote, fiind considerate adevărate "centrale energetice" ale celulelor. Aceste structuri microscopice au forma unor bastonașe sau filamente cu diametrul de aproximativ 0,5-1 micrometri și lungimea variabilă între 1-10 micrometri. Deși dimensiunile lor sunt minuscule, importanța mitocondriilor pentru supraviețuirea celulară este incontestabilă.

Descoperirea mitocondriilor datează din a doua jumătate a secolului al XIX-lea, când Richard Altmann le-a observat pentru prima dată în 1890, numindu-le "biobolaști". Totuși, termenul de "mitocondrie" a fost introdus ulterior de Carl Benda în 1898, fiind derivat din cuvintele grecești "mitos" (fir) și "chondrion" (granulă), reflectând aspectul lor filamentos.
Numărul mitocondriilor variază semnificativ de la un tip celular la altul, în funcție de necesitățile energetice. Astfel, celulele cu activitate metabolică intensă, precum cele musculare, hepatice sau neuronale, conțin mii de mitocondrii, în timp ce celulele cu activitate metabolică redusă pot avea doar câteva zeci. De exemplu, o celulă hepatică poate conține până la 2000 de mitocondrii, reprezentând aproximativ 20% din volumul celular.
Mitocondriile se disting de alte organite celulare prin faptul că posedă propriul lor ADN (ADN mitocondrial sau ADNmt) și pot să se reproducă independent de diviziunea celulară. Această caracteristică unică stă la baza teoriei endosimbiotice, formulată de Lynn Margulis în anii 1960, potrivit căreia mitocondriile au evoluat din bacterii libere care au stabilit o relație simbiotică cu celulele primitive acum aproximativ 1,5-2 miliarde de ani.
Cum se înmulțesc mitocondriile?
Procesul de înmulțire a mitocondriilor, cunoscut sub numele de biogeneză mitocondrială, este un fenomen complex și fascinant. Spre deosebire de alte organite celulare, mitocondriile nu sunt formate de novo, ci se reproduc prin diviziune, similar bacteriilor.
Diviziunea mitocondrială
Procesul principal de înmulțire a mitocondriilor este diviziunea sau fisiunea mitocondrială. Aceasta implică mai mulți pași:
- Replicarea ADN-ului mitocondrial: Înainte de diviziune, ADN-ul mitocondrial trebuie să se replice pentru a asigura prezența materialului genetic în ambele organite rezultate.
- Elongarea mitocondriei: Mitocondria își mărește volumul și se alungește, pregătindu-se pentru diviziune.
- Constricția și fisiunea: Proteinele specifice, precum Drp1 (proteina 1 înrudită cu dinamina), sunt recrutate la locul diviziunii, formând un inel de constricție care strânge mitocondria la mijloc, ducând la separarea în două organite distincte.
Acest proces este reglat strict de factori precum necesitățile energetice celulare, semnale de stres și ciclul celular.
Factori care influențează biogeneza mitocondrială
Biogeneza mitocondrială este stimulată de diverși factori, inclusiv:
- Exercițiul fizic: Activitatea fizică intensă crește necesarul energetic al celulelor musculare, stimulând înmulțirea mitocondriilor.
- Expunerea la frig: Temperaturile scăzute induc termogeneza, care necesită o activitate mitocondrială crescută.
- Factori de transcripție: PGC-1α (coactivatorul 1-alfa al receptorului gama activat de proliferatorul peroxizomilor) este considerat "regele biogenezei mitocondriale", coordonând expresia genelor implicate în acest proces.
- Restricția calorică: Studiile au arătat că reducerea aportului caloric poate stimula biogeneza mitocondrială, contribuind la efectele benefice asupra longevității.
O particularitate interesantă este că biogeneza mitocondrială implică coordonarea între două genomuri diferite - cel nuclear și cel mitocondrial. Astfel, deși mitocondriile posedă propriul lor ADN, majoritatea proteinelor mitocondriale (peste 99%) sunt codate de genomul nuclear, sintetizate în citoplasmă și apoi importate în mitocondrii.
Dinamica mitocondrială: fuziune și fisiune
Pe lângă diviziune, mitocondriile participă la un proces dinamic de fuziune și fisiune, cunoscut sub numele de "dinamica mitocondrială". Acest proces permite mitocondriilor să formeze rețele complexe, să schimbe componente și să optimizeze funcționalitatea.
- Fuziunea mitocondrială: Este mediată de proteinele Mitofusine (Mfn1 și Mfn2) și OPA1, care permit unirea a două mitocondrii într-una singură.
- Fisiunea mitocondrială: Este facilitată de proteinele Drp1 și Fis1, care permit diviziunea mitocondriilor.
Echilibrul între fuziune și fisiune este esențial pentru sănătatea mitocondrială și celulară. Perturbarea acestui echilibru este asociată cu diverse patologii, de la boli neurodegenerative la cancere.
Structura mitocondriilor
Mitocondriile prezintă o structură complexă și distinctă, adaptată perfect funcțiilor lor multiple. Analiza ultrastructurală prin microscopie electronică a relevat o organizare sofisticată, cu multiple compartimente și membrane.
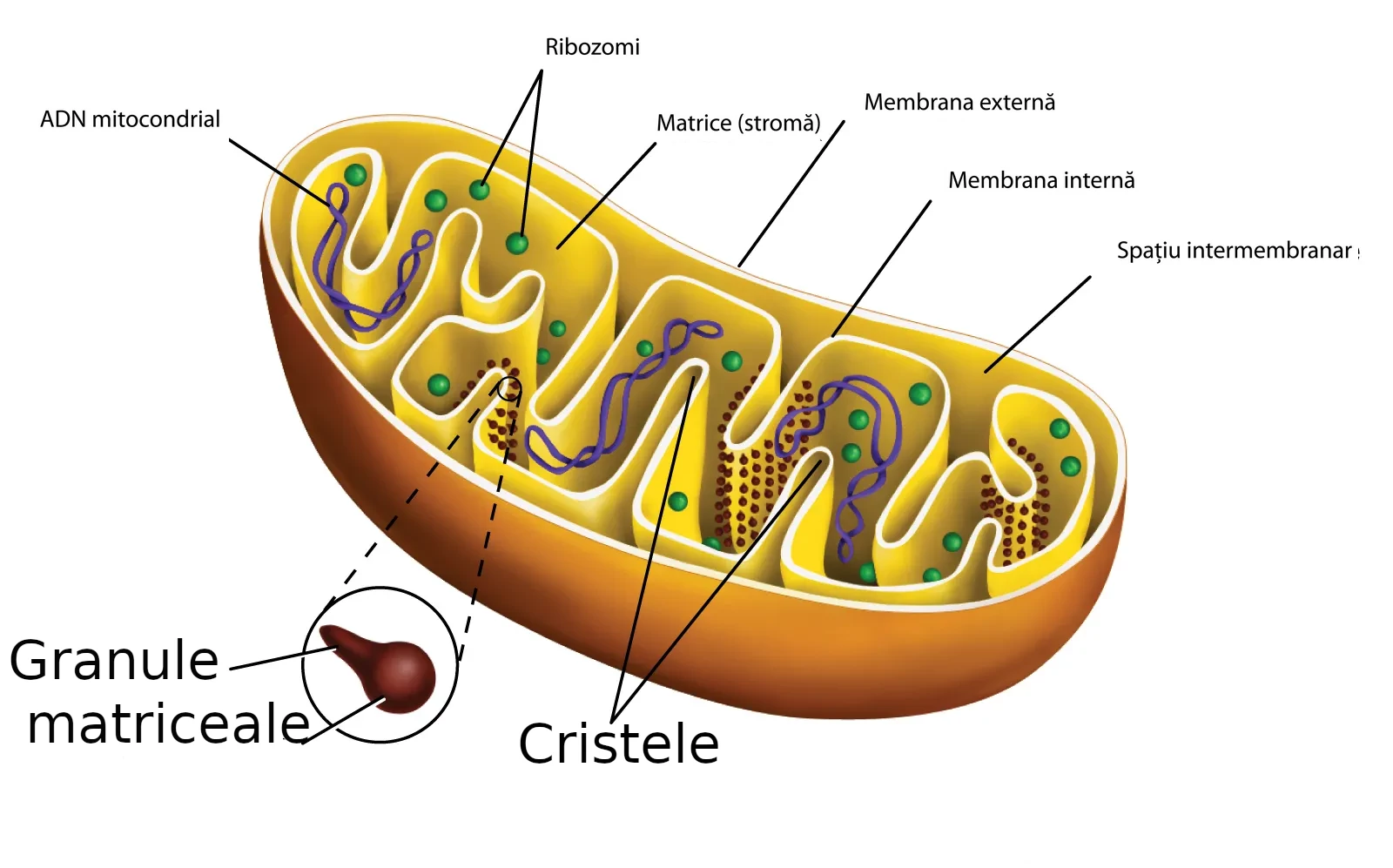
Membrane ale mitocondriilor
Mitocondriile sunt înconjurate de două membrane distincte:
- Membrana externă mitocondrială (MEM): Este o membrană lipidică relativ simplă, similară cu membrana plasmatică. Aceasta conține numeroase proteine numite porine (sau VDAC - canale anionice dependente de voltaj), care formează pori ce permit trecerea liberă a moleculelor mici (sub 5 kDa) și a ionilor. Membrana externă reprezintă bariera inițială între mitocondrie și citoplasmă.
- Membrana internă mitocondrială (MIM): Spre deosebire de membrana externă, membrana internă este mult mai complexă și selectivă. Ea este caracterizată prin:
- Conținut ridicat de cardiolipină, un fosfolipid specific care conferă impermeabilitate
- Prezența numeroaselor proteine implicate în lanțul respirator și fosforilarea oxidativă
- Formarea unor invaginații numeroase numite criste mitocondriale, care măresc considerabil suprafața membranei
Aceste două membrane delimitează două compartimente distincte:
Compartimente mitocondriale
- Spațiul intermembranar: Situat între membrana externă și cea internă, acest compartiment are o compoziție similară cu citoplasma în ceea ce privește ionii și moleculele mici. Totuși, conține proteine specifice implicate în apoptoză (precum citocromul c) și în transportul proteinelor.
- Matricea mitocondrială: Este spațiul delimitat de membrana internă, reprezentând cel mai mare compartiment mitocondrial. Matricea conține:
- ADN-ul mitocondrial
- Ribozomi mitocondriali pentru sinteza proteică
- Enzime implicate în ciclul Krebs și beta-oxidarea acizilor grași
- Granule matriceale bogate în calciu și alte minerale
- Diverse metaboliți intermediari
Cristele mitocondriale
Una dintre cele mai distinctive caracteristici structurale ale mitocondriilor sunt cristele - invaginații ale membranei interne în matrice. Cristele nu sunt simple plieri aleatorii, ci structuri organizate cu morfologie specifică:
- Lamelare: Aspect de rafturi paralele, întâlnite în majoritatea celulelor
- Tubulare: Formă cilindrică, prezente în celulele adrenale care sintetizează steroizi
- Veziculare: Structuri sferice, observate în anumite țesuturi patologice
Densitatea și orientarea cristelor reflectă activitatea metabolică a celulei. Celulele cu necesar energetic ridicat (precum cele musculare cardiace) prezintă mitocondrii cu criste foarte dense și numeroase.
Punctele de contact membranar
Cercetările recente au identificat zone specializate unde membrana externă și cea internă vin în contact direct, numite "puncte de contact membranar" sau "joncțiuni membranare mitocondriale". Aceste structuri joacă roluri esențiale în:
- Importul proteinelor în mitocondrii
- Transferul lipidelor între membrane
- Semnalizarea celulară
- Dinamica mitocondrială (fuziune și fisiune)
ADN mitocondrial
ADN-ul mitocondrial (ADNmt) reprezintă o caracteristică distinctivă a mitocondriilor, fiind o moștenire genetică a originii lor bacteriene. Acest material genetic unic are proprietăți specifice care îl diferențiază de ADN-ul nuclear.
Structura și organizarea ADN-ului mitocondrial
La oameni, ADNmt este o moleculă circulară de ADN dublu catenar, cu o lungime de aproximativ 16.569 perechi de baze. Spre deosebire de ADN-ul nuclear împachetat în nucleosome, ADNmt este organizat în structuri numite nucleoide, care conțin multiple copii de ADNmt asociate cu proteine specifice, precum TFAM (factorul de transcripție A mitocondrial).
Caracteristici notabile ale ADNmt uman includ:
- Compactitate extremă: Aproape 93% din secvență codifică pentru gene, fără introni și cu regiuni intergenice minime.
- Codul genetic modificat: ADNmt utilizează un cod genetic ușor diferit de cel nuclear standard. De exemplu, codonul UGA, care în codul standard codifică un stop, în mitocondrie codifică pentru triptofan.
- Structura circulară: Forma circulară oferă stabilitate și reduce riscul de degradare.
- Prezența regiunii D-loop: O regiune non-codantă de aproximativ 1.1 kb, implicată în replicare și transcripție.
Conținutul genetic al ADNmt
Genomul mitocondrial uman codifică pentru un total de 37 de gene:
- 13 gene care codifică pentru subunități ale complexelor lanțului respirator
- 22 gene pentru ARN de transfer (ARNt)
- 2 gene pentru ARN ribozomal (ARNr 16S și 12S)
Toate cele 13 proteine codate de ADNmt sunt componente esențiale ale lanțului transportor de electroni, implicat direct în producerea de ATP:
- 7 subunități ale complexului I (NADH dehidrogenază)
- 1 subunitate a complexului III (citocrom b)
- 3 subunități ale complexului IV (citocrom c oxidază)
- 2 subunități ale complexului V (ATP sintază)
Este important de menționat că aceste 13 proteine reprezintă doar o fracțiune din totalul proteinelor mitocondriale (estimat la peste 1500). Restul sunt codate de genomul nuclear, sintetizate în citoplasmă și importate în mitocondrii.
Ereditatea mitocondrială
O caracteristică unică a ADNmt este modul său de transmitere:
- Ereditate maternă: În reproducerea sexuată, ADNmt este moștenit exclusiv de la mamă. Spermatozoidul contribuie cu ADN nuclear, dar mitocondriile sale sunt eliminate selectiv după fertilizare sau diluate semnificativ de către cele ale ovulului.
- Homoplasmie și heteroplasmie: În mod normal, toate moleculele de ADNmt dintr-un individ sunt identice (homoplasmie). Totuși, pot apărea mutații care afectează doar o parte din moleculele de ADNmt, ducând la heteroplasmie - coexistența ADNmt normal și mutant în aceeași celulă sau organism.
- Efectul de gât de sticlă: În timpul dezvoltării ovariene, doar o subpopulație de molecule de ADNmt este transmisă generației următoare, ceea ce poate amplifica sau reduce proporția de ADNmt mutant.
Rata de mutație și evoluție
ADNmt prezintă o rată de mutație de 5-10 ori mai mare decât ADN-ul nuclear, din cauza:
- Expunerii la specii reactive de oxigen generate în lanțul respirator
- Sistemelor limitate de reparare a ADN-ului
- Absenței histonelor protectoare
Această rată ridicată de mutație face din ADNmt un instrument valoros în studiile evolutive și în genetica populațiilor. Analiza "ceasului molecular" bazat pe mutațiile ADNmt a permis reconstruirea migrațiilor umane străvechi și stabilirea relațiilor filogenetice între populații.
ADNmt în arheologie și antropologie
Datorită numărului mare de copii per celulă și stabilității relative, ADNmt poate fi extras din rămășițe antice, permițând:
- Identificarea relațiilor de rudenie în siturile arheologice
- Reconstruirea demografiei populațiilor istorice
- Trasarea migrațiilor umane de-a lungul istoriei
Un exemplu celebru este utilizarea ADNmt pentru a stabili că toate liniile materne umane moderne converg către o strămoașă comună, supranumită "Eva mitocondrială", care a trăit în Africa acum aproximativ 150.000-200.000 de ani.
Ce fac mitocondriile?
Rolul principal al mitocondriilor este producerea de energie sub formă de ATP (adenozin trifosfat), dar funcțiile lor se extind mult dincolo de acest aspect, implicându-le în numeroase procese celulare vitale.
Producerea energiei celulare
Mitocondriile sunt renumite pentru rolul lor în generarea ATP-ului prin procesul de fosforilare oxidativă. Acest proces complex implică mai multe etape interdependente:
- Ciclul Krebs (ciclul acidului citric): Are loc în matricea mitocondrială și oxidează acetil-CoA (derivat din glucoză, acizi grași sau aminoacizi) generând NADH și FADH₂, molecule bogate în electroni.
- Lanțul respirator (lanțul transportor de electroni): Localizat în membrana internă mitocondrială, este format din patru complexe proteice (I-IV) care transferă electroni de la NADH și FADH₂ la oxigen molecular, eliberând energie.
- Fosforilarea oxidativă: Energia eliberată în lanțul respirator este utilizată de complexul V (ATP sintaza) pentru a fosforila ADP în ATP.
O singură moleculă de glucoză poate genera până la 30-32 molecule de ATP prin metabolismul mitocondrial, în comparație cu doar 2 molecule de ATP produse prin glicoliză în citoplasmă.
Homeostazia calciului
Mitocondriile joacă un rol crucial în reglarea concentrațiilor intracelulare de calciu:
- Acționează ca "tampoane" de calciu, absorbind excesul de Ca²⁺ din citoplasmă
- Eliberează Ca²⁺ în răspuns la diverși stimuli celulari
- Contribuie la propagarea semnalelor de calciu în celulă
- Participă la sincronizarea activității între mitocondrii prin oscilații de calciu
Perturbarea homeostaziei calciului mitocondriale poate declanșa deschiderea porului de tranziție al permeabilității mitocondriale (mPTP), ducând la eliberarea factorilor pro-apoptotici.
Apoptoza și moartea celulară programată
Mitocondriile sunt "gardieni" ai vieții celulare, jucând un rol central în apoptoză - procesul de moarte celulară programată:
- Conțin proteine pro-apoptotice (citocrom c, AIF, Smac/DIABLO) în spațiul intermembranar
- Integrează semnale de stres celular și determină "decizia" de viață sau moarte a celulei
- Eliberează factori apoptotici în citoplasmă prin permeabilizarea membranei externe
- Activează căile de activare a caspazelor, ducând la degradarea controlată a componentelor celulare
Această funcție este esențială pentru dezvoltarea normală, eliminarea celulelor disfuncționale și prevenirea cancerului.
Biosinteza hemului și a grupărilor fier-sulf
Mitocondriile sunt implicate în biosinteza unor cofactori esențiali:
- Hemul: Component crucial al hemoglobinei, mioglobinei și citocromilor, este sintetizat parțial în mitocondrii.
- Grupările fier-sulf (Fe-S): Cofactori inorganici esențiali pentru numeroase proteine implicate în transferul de electroni, cataliză și senzori de oxigen.
Biosinteza hormonilor steroizi
În celulele secretoare de steroizi (precum cele din cortexul adrenal, testicule și ovare), mitocondriile participă la biosinteza hormonilor steroizi prin:
- Conversia colesterolului în pregnenolon (pasul limitant în steroidogeneză)
- Găzduirea enzimelor implicate în hidroxilări specifice ale precursorilor steroidieni
Termogeneza
În țesutul adipos brun, mitocondriile sunt specializate pentru termogeneză (producerea de căldură) prin:
- Expresia proteinei UCP1 (proteina de decuplare 1), care permite disiparea gradientului de protoni sub formă de căldură în loc de producere ATP
- Oxidarea intensă a acizilor grași pentru alimentarea termogenezei
Acest proces este esențial pentru termoreglare la nou-născuți și contribuie la cheltuielile energetice la adulți.
Metabolismul aminoacizilor
Mitocondriile participă activ la metabolismul aminoacizilor prin:
- Găzduirea enzimelor implicate în ciclul ureei, esențial pentru eliminarea amoniacului toxic
- Participarea la transaminare și dezaminare oxidativă
- Degradarea aminoacizilor cu lanț ramificat (valină, leucină, izoleucină)
Metabolismul lipidelor
Mitocondriile sunt centrale în metabolismul lipidic prin:
- Beta-oxidarea acizilor grași, principala cale de degradare a acizilor grași pentru producerea energiei
- Sinteza unor fosfolipide specifice
- Participarea la metabolismul corpilor cetonici în timpul înfometării
Semnalizare celulară
În ultimele decenii, a devenit evident că mitocondriile funcționează ca platforme de semnalizare celulară prin:
- Generarea de specii reactive de oxigen (ROS) ca mesageri secundari
- Eliberarea de metaboliți intermediari care reglează activitatea enzimelor și factorilor de transcripție
- Modificarea metabolismului în răspuns la semnale de stres
- Comunicarea bidirecțională cu nucleul (semnalizare retrogradă și anterogradă)
Probleme de sănătate legate de mitocondrii
Disfuncțiile mitocondriale sunt implicate într-o gamă largă de afecțiuni, de la boli genetice rare până la patologii comune asociate vârstei.
Boli mitocondriale primare
Bolile mitocondriale primare sunt afecțiuni cauzate direct de defecte genetice care afectează funcția mitocondrială. Acestea pot rezulta din mutații în ADN-ul mitocondrial sau în genele nucleare care codifică proteine mitocondriale.
Sindroame asociate mutațiilor ADNmt
- Sindromul MELAS (Miopatie, Encefalopatie, Acidoză Lactică și Episoade similare accidentului vascular cerebral):
- Cauzat frecvent de mutația m.3243A>G în gena ARNt pentru leucină
- Manifestări: convulsii, demență, acidoză lactică, deficite motorii, accident vascular cerebral-like la vârste tinere
- Prevalență: aproximativ 1 la 4000 de indivizi
- Sindromul MERRF (Epilepsie Mioclonică cu Fibre Roșii Rupte):
- Asociat cu mutația m.8344A>G în gena ARNt pentru lizină
- Simptome: mioclonii, epilepsie, ataxie, demență, surditate neurosenzorială
- Debut tipic în adolescență sau tinerețe
- Neuropatia optică ereditară Leber (LHON):
- Cauzată de mutații punctiforme în genele ce codifică pentru complexul I
- Manifestare principală: pierderea vederii centrale bilaterală, rapidă și nedureroasă
- Afectează predominant bărbații tineri
- Are o penetranță incompletă (nu toți purtătorii dezvoltă boala)
- Sindromul Leigh:
- Encefalopatie neurodegenerativă progresivă
- Poate fi cauzat de mutații în ADNmt sau ADN nuclear
- Afectează predominant copiii sub 2 ani
- Manifestări: regres neurologic, hipotonie, probleme de alimentație, insuficiență respiratorie
Boli mitocondriale cauzate de mutații în genele nucleare
- Sindromul de deplețiere a ADNmt:
- Reducerea severă a cantității de ADNmt în țesuturi
- Cauzat de mutații în gene implicate în replicarea și menținerea ADNmt (ex. POLG, DGUOK, TK2)
- Forme hepatice, miopatice sau encefalomiopatice
- Ataxia Friedreich:
- Cauzată de expansiunea repetițiilor GAA în gena FXN care codifică frataxina
- Frataxina este esențială pentru biosinteza grupărilor fier-sulf în mitocondrii
- Manifestări: ataxie progresivă, cardiomiopatie, diabet
- Sindromul Barth:
- Mutații în gena TAZ care codifică tafazzina, o proteină implicată în remodelarea cardiolipinei
- Afectează predominant băieții (transmitere X-linkată)
- Manifestări: cardiomiopatie, neutropenie ciclică, miopatie, creștere întârziată
Caracteristici clinice ale bolilor mitocondriale
Bolile mitocondriale sunt caracterizate prin:
- Heterogenitate clinică: Aceeași mutație poate cauza manifestări diferite la diferiți pacienți
- Afectare multisistemică: Țesuturile cu necesar energetic ridicat (mușchi, creier, inimă, ficat, rinichi) sunt frecvent afectate
- Progresia fluctuantă: Perioadele de stabilitate alternează cu deteriorări acute
- Efectul pragului: Manifestările clinice apar când proporția de ADNmt mutant depășește un anumit prag, specific pentru fiecare țesut
Mitocondriile în boli neurodegenerative
Disfuncția mitocondrială joacă un rol central în patogeneza multor boli neurodegenerative:
- Boala Parkinson:
- Defecte în complexul I al lanțului respirator
- Mutații în gene implicate în controlul calității mitocondriale (PINK1, Parkin, DJ-1)
- Acumularea de mitocondrii disfuncționale din cauza mitofagiei defectuoase
- Boala Alzheimer:
- Alterarea dinamicii mitocondriale (dezechilibru fuziune-fisiune)
- Reducerea activității lanțului respirator
- Interacțiunea toxică între peptidele beta-amiloid și mitocondrii
- Scleroza laterală amiotrofică (SLA):
- Mutații în SOD1 cauzează stres oxidativ mitocondrial
- Transport axonal defectuos al mitocondriilor
- Activarea căilor apoptotice mitocondriale
Mitocondriile în cancer
Relația dintre mitocondrii și cancer este complexă și bidirectională:
- Efectul Warburg: Multe celule canceroase prezintă o glicolitică aerobă crescută și reducerea fosforilării oxidative mitocondriale
- Mutații în ADNmt: Frecvent întâlnite în diverse tipuri de cancere, pot contribui la progresia tumorală
- Alterarea dinamicii mitocondriale: Dezechilibrul între fuziune și fisiune favorizează proliferarea celulară și metastazarea
- Reprogramarea metabolică: Adaptări metabolice ale mitocondriilor care susțin creșterea tumorală prin furnizarea de intermediari pentru biosinteza macromoleculelor
Mitocondriile în diabetul zaharat
Disfuncția mitocondrială contribuie la patogeneza diabetului de tip 2 prin:
- Reducerea capacității oxidative în mușchii scheletici, ducând la rezistență la insulină
- Afectarea secreției de insulină dependente de ATP în celulele beta pancreatice
- Stresul oxidativ mitocondrial care compromite semnalizarea insulinică
Mitocondriile în afecțiuni cardiace
Inima, cu necesarul său energetic ridicat, este deosebit de vulnerabilă la disfuncțiile mitocondriale:
- Cardiomiopatii: Defectele mitocondriale pot cauza cardiomiopatii dilatative sau hipertrofice
- Insuficiența cardiacă: Caracterizată prin reducerea producerii de ATP și creșterea stresului oxidativ mitocondrial
- Cardiotoxicitatea medicamentoasă: Multe medicamente (ex. doxorubicina) induc cardiotoxicitate prin afectarea mitocondriilor
Abordări terapeutice în bolile mitocondriale
Tratamentul bolilor mitocondriale rămâne o provocare majoră, dar câteva strategii promițătoare includ:
- Suplimentarea cofactorilor:
- Coenzima Q10
- L-carnitină
- Vitamina B (riboflavină, tiamină)
- Acid alfa-lipoic
- Terapii antioxidante:
- Idebenona (analog al CoQ10)
- N-acetilcisteină
- Vitamina C și E
- Modificarea ADNmt:
- Tehnici de editare a genomului (CRISPR/Cas9 adaptate pentru mitocondrii)
- Transferul mitocondriilor sănătoase
- Terapii de substituție metabolică:
- Diete cetogene pentru a oferi surse alternative de energie
- Dicloracetat pentru reducerea acidozei lactice
- Înlocuirea nucleului:
- Transferul nucleului dintr-un ovul cu ADNmt mutant într-un ovul donor cu ADNmt sănătos
- Această tehnică controversată a dus la nașterea primilor "copii cu trei părinți"
Mitocondriile și îmbătrânirea
Relația dintre mitocondrii și procesul de îmbătrânire a fost obiectul intenselor cercetări științifice în ultimele decenii, conducând la formularea "teoriei mitocondriale a îmbătrânirii".
Teoria mitocondrială a îmbătrânirii
Propusă inițial în anii 1950 și dezvoltată ulterior, teoria mitocondrială a îmbătrânirii (cunoscută și ca teoria radicalilor liberi mitocondriali) sugerează că îmbătrânirea este rezultatul acumulării progresive a daunelor provocate de speciile reactive de oxigen (ROS) produse de mitocondrii în timpul respirației celulare.
Mecanismul disfuncției mitocondriale în procesul de îmbătrânire
- Producerea de ROS și stresul oxidativ În timpul fosforilării oxidative, aproximativ 1-2% din electronii transportați de-a lungul lanțului respirator "scapă", reacționând cu oxigenul molecular și formând superoxid (O2•-), un radical liber extrem de reactiv. Acesta poate fi convertit în alți ROS, precum peroxidul de hidrogen (H2O2) și radicalul hidroxil (OH•), care pot deteriora proteinele, lipidele și ADN-ul.
- Vulnerabilitatea ADN-ului mitocondrial ADNmt este deosebit de vulnerabil la atacul ROS datorită:
- Proximității față de lanțul transportor de electroni, principala sursă de ROS
- Lipsei proteinelor histone protectoare
- Mecanismelor limitate de reparare a ADN-ului comparativ cu ADN-ul nuclear
- Ciclul vicios al disfuncției mitocondriale Deteriorarea ADNmt duce la sinteza defectuoasă a proteinelor implicate în lanțul respirator, ceea ce conduce la:
- Scăderea eficienței producerii de ATP
- Creșterea producției de ROS
- Amplificarea deteriorării ADNmt
- Crearea unui ciclu vicios de disfuncție mitocondrială accelerată
Dovezi științifice ale implicării mitocondriilor în îmbătrânire
Numeroase studii susțin rolul central al mitocondriilor în procesul de îmbătrânire:
Studii pe modele animale
- Șoareci cu ADNmt mutant Cercetătorii au dezvoltat șoareci cu o versiune mutantă a ADN polimerazei mitocondriale (POLG), care duce la acumularea accelerată de mutații în ADNmt. Acești șoareci prezintă semne de îmbătrânire prematură, inclusiv pierderea părului, reducerea masei musculare, osteoporoză și scăderea longevității.
- Drosophila melanogaster (musculița de oțet) Experimente pe Drosophila au arătat că supraexpresia enzimelor antioxidante mitocondriale, precum superoxid dismutaza mitocondrială (SOD2), poate prelungi durata de viață.
- Caenorhabditis elegans (vierme nematod) Mutații în genele implicate în funcția mitocondrială pot influența dramatic durata de viață a acestor viermi, fie reducând-o, fie crescând-o, în funcție de gradul de disfuncție mitocondrială.
Studii pe țesuturi umane
Țesuturile umane îmbătrânite prezintă:
- Creșterea numărului de mutații și deleții în ADNmt
- Reducerea activității complexelor lanțului respirator
- Morfologie mitocondrială anormală
- Nivele crescute de proteine și lipide oxidate
Implicațiile disfuncției mitocondriale în bolile asociate vârstei
Disfuncția mitocondrială este implicată în patogeneza multor boli asociate vârstei:
Boli neurodegenerative
- Boala Alzheimer Cercetările au demonstrat că disfuncția mitocondrială apare în stadii timpurii ale bolii Alzheimer, înainte de formarea plăcilor amiloide. Neuronii afectați prezintă:
- Reducerea producției de ATP
- Homeostază perturbată a calciului
- Nivele crescute de ROS
- Transport mitocondrial defectuos de-a lungul axonilor
- Boala Parkinson Disfuncția mitocondrială joacă un rol crucial în boala Parkinson:
- Mutații în gene care controlează dinamica mitocondrială (PINK1, Parkin) cauzează forme familiale ale bolii
- Toxine care inhibă complexul I mitocondrial pot induce simptome parkinsoniene
- Neuronii dopaminergici sunt deosebit de sensibili la stresul oxidativ datorită metabolismului dopaminei
Boli cardiovasculare
Miocitele cardiace conțin un număr mare de mitocondrii datorită necesităților energetice ridicate. Disfuncția mitocondrială contribuie la:
- Cardiomiopatii
- Insuficiență cardiacă
- Ateroscleroză
Diabetul de tip 2
Disfuncția mitocondrială în celulele β pancreatice și în mușchii scheletici contribuie la rezistența la insulină și la progresia diabetului de tip 2.
Strategii pentru îmbunătățirea funcției mitocondriale și încetinirea îmbătrânirii
Intervenții alimentare
- Restricția calorică Reducerea aportului caloric fără malnutriție a demonstrat că prelungește durata de viață în multiple specii. Mecanismele includ:
- Reducerea producției de ROS
- Stimularea biogenezei mitocondriale
- Activarea sirtuinelor, o familie de proteine implicate în reglarea metabolismului și longevității
- Dieta ketogenică Dieta bogată în grăsimi și săracă în carbohidrați poate îmbunătăți funcția mitocondrială prin:
- Creșterea numărului de mitocondrii
- Îmbunătățirea eficienței lanțului respirator
- Reducerea producției de ROS
- Nutrienți specifici Anumite nutriente pot susține funcția mitocondrială:
- Coenzima Q10 - componentă esențială a lanțului respirator
- Acid alfa-lipoic - antioxidant mitocondrial puternic
- Resveratrol - activator al SIRT1, o sirtuină implicată în biogeneza mitocondrială
- Acid N-acetil cisteină - precursor al glutationului, un antioxidant major
Exercițiul fizic
Activitatea fizică regulată stimulează biogeneza mitocondrială prin activarea PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), un regulator cheie al metabolismului energetic.
Studiile arată că:
- Antrenamentul de rezistență crește densitatea mitocondrială în mușchii scheletici
- Exercițiul fizic reduce acumularea de mutații în ADNmt
- Activitatea fizică regulată îmbunătățește funcția lanțului respirator
Abordări farmacologice
Cercetătorii explorează diverse molecule care țintesc mitocondriile pentru a încetini îmbătrânirea:
- Mimetics ale restricției calorice Compuși precum:
- Metformin - medicament antidiabetic care activează AMPK (AMP-activated protein kinase)
- Rapamycin - inhibitor al mTOR (mammalian target of rapamycin)
- Antioxidanți mitocondriali țintiti Molecule proiectate să se acumuleze selectiv în mitocondrii:
- MitoQ
- SS-31 (Elamipretide)
- SKQ1
- Suplimente NAD+ Nicotinamid adenin dinucleotid (NAD+) este un cofactor esențial pentru funcționarea sirtuinelor. Precursorii NAD+, precum:
- Nicotinamid ribozidul (NR)
- Nicotinamid mononucleotidul (NMN) au demonstrat îmbunătățiri ale funcției mitocondriale în studii pe animale.
Terapii emergente bazate pe mitocondrii
Transferul mitocondrial
Transferul de mitocondrii sănătoase în celule cu disfuncție mitocondrială reprezintă o abordare promițătoare pentru rejuvenarea celulară. Această tehnică a fost testată în:
- Boli mitocondriale
- Boli neurodegenerative
- Regenerarea tisulară
Terapia genică mitocondrială
Deși complexă din cauza provocărilor de a introduce ADN în mitocondrii, cercetătorii explorează metode pentru:
- Corectarea mutațiilor în ADNmt
- Introducerea de gene pentru enzime antioxidante mitocondriale
- Expresia factorilor care stimulează biogeneza mitocondrială
Ingineria ADNmt
Dezvoltarea tehnologiei CRISPR adaptate pentru mitocondrii ar putea permite:
- Eliminarea selectivă a ADNmt mutant
- Repararea precisă a mutațiilor în ADNmt
- Înlocuirea completă a ADNmt cu versiuni "întinerite"
Concluzii și perspective de viitor
Mitocondriile reprezintă adevărate centrale energetice ale celulelor noastre, având un rol esențial în funcționarea optimă a organismului. Aceste organite complexe, cu structura lor caracteristică formată din două membrane, posedă propriul lor ADN și se înmulțesc independent de ciclul celular. Funcția lor principală de a produce ATP prin fosforilare oxidativă este fundamentală pentru toate procesele biologice care necesită energie.
Disfuncțiile mitocondriale sunt implicate într-o gamă largă de afecțiuni, de la boli metabolice rare la tulburări neurodegenerative comune, subliniind importanța crucială a acestor organite pentru sănătatea generală. Mai mult, cercetările recente sugerează că mitocondriile joacă un rol central în procesul de îmbătrânire, consolidând teoria că acumularea de mutații în ADN-ul mitocondrial contribuie la declinul funcțional asociat vârstei.
Înțelegerea aprofundată a biologiei mitocondriale deschide perspective promițătoare pentru dezvoltarea de noi strategii terapeutice care vizează afecțiunile cauzate de disfuncții mitocondriale. Progresele în cercetarea mitocondriilor ne pot oferi în viitor posibilitatea de a interveni în procesele de îmbătrânire și de a îmbunătăți calitatea vieții, mai ales la vârste înaintate.
În concluzie, aceste minuscule organite reprezintă nu doar sursa energiei celulare, ci și un element cheie în înțelegerea sănătății, bolii și îmbătrânirii. Continuarea cercetărilor în acest domeniu va dezvălui cu siguranță noi aspecte fascinante ale biologiei mitocondriale și va deschide calea către abordări inovatoare în medicină și biologie.
Înțelegerea rolului mitocondriilor în procesul de îmbătrânire a evoluat semnificativ în ultimele decenii, de la teoria inițială a radicalilor liberi la o viziune mult mai complexă care recunoaște implicarea mitocondriilor în multiple aspecte ale îmbătrânirii celulare.
Cercetările viitoare se vor concentra probabil pe:
- Dezvoltarea de biomarkeri ai funcției mitocondriale pentru evaluarea intervențiilor anti-îmbătrânire
- Identificarea de compuși terapeutici care țintesc specific disfuncția mitocondrială asociată vârstei
- Personalizarea strategiilor de intervenție bazate pe profilul genetic mitocondrial individual