Reglarea hormonală a metabolismului
- Detalii
- Categorie: Endocrinologie
- Accesări: 8,432
Metabolismul reprezintă totalitatea proceselor biochimice prin care organismul nostru transformă nutrienții în energie și substanțe necesare funcționării optime. În spatele acestui sistem complex se află un mecanism de reglare hormonală sofisticat, care coordonează rata metabolismului, distribuția nutrienților și homeostazia energetică. Înțelegerea modului în care hormonii influențează metabolismul poate oferi perspective valoroase pentru gestionarea greutății, prevenirea bolilor metabolice și îmbunătățirea stării generale de sănătate.
Hormonii principali implicați în reglarea metabolismului
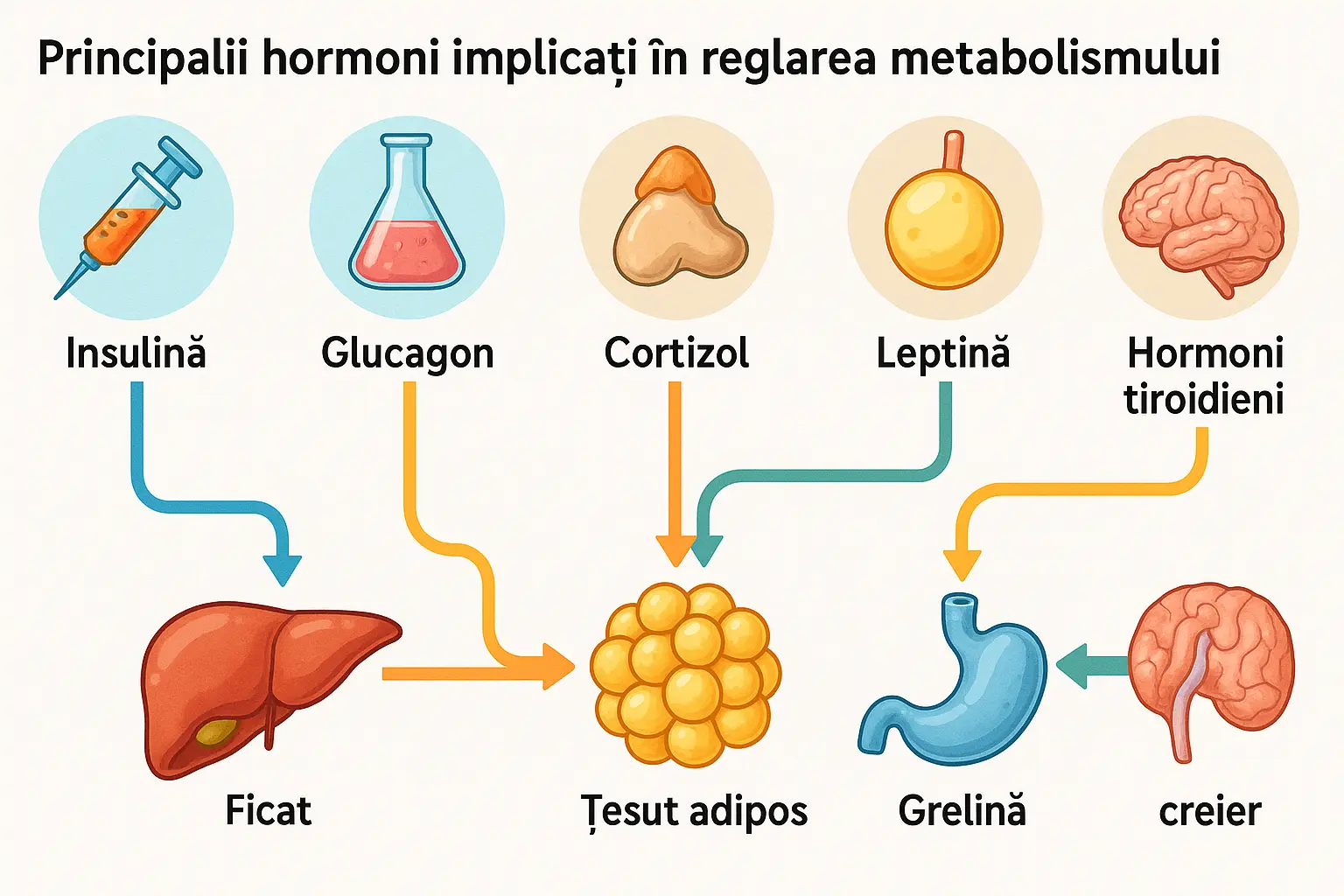
Insulina - Maestrul stocării energiei
Insulina, produsă de celulele beta din pancreas, este unul dintre cei mai importanți hormoni metabolici. Rolurile sale principale includ:
- Facilitarea absorbției glucozei din sânge în celule
- Stimularea depozitării glicogenului în ficat și mușchi
- Promovarea sintezei de acizi grași și inhibarea lipolizei
- Reglarea nivelurilor de glucoză din sânge
Disfuncțiile în secreția sau acțiunea insulinei pot duce la diabet zaharat, rezistență la insulină și sindrom metabolic.
Glucagonul - Contrapartea insulinei
Produs de celulele alfa din pancreas, glucagonul acționează în opoziție cu insulina pentru a menține homeostazia glucozei:
- Stimulează descompunerea glicogenului hepatic (glicogenoliza)
- Promovează gluconeogeneza (formarea de glucoză din surse non-glucidice)
- Activează lipoliza (descompunerea grăsimilor)
- Crește nivelul glucozei sanguine în condiții de hipoglicemie
Hormonii tiroidieni (T3 și T4)
Tiroxina (T4) și triiodotironina (T3) sunt secretate de glanda tiroidă și au un impact profund asupra ratei metabolice bazale:
- Cresc consumul de oxigen și producția de căldură
- Accelerează metabolismul carbohidraților, proteinelor și lipidelor
- Reglează sensibilitatea la insulină
- Influențează dezvoltarea și creșterea
Hipotiroidismul (producție insuficientă) poate duce la încetinirea metabolismului și creștere în greutate, în timp ce hipertiroidismul (producție excesivă) poate cauza pierdere în greutate și accelerarea metabolismului.
Cortizolul - Hormonul stresului
Produs de glandele suprarenale, cortizolul joacă un rol crucial în adaptarea metabolică la stres:
- Stimulează gluconeogeneza și crește nivelul glucozei în sânge
- Mobilizează acizii grași din țesutul adipos
- Promovează catabolismul proteinelor
- Antagonizează efectele insulinei
Niveluri cronice ridicate de cortizol pot contribui la rezistența la insulină, obezitate abdominală și sindrom metabolic.
Leptina și grelina - Reglatorii apetitului
Acești hormoni sunt esențiali pentru reglarea aportului alimentar și a homeostaziei energetice:
- Leptina (hormonul sațietății) - secretată de țesutul adipos, semnalează creierului starea rezervelor de grăsime și suprimă apetitul
- Grelina (hormonul foamei) - produsă în stomac, stimulează apetitul și promovează stocarea grăsimilor
Dezechilibrele în sistemul leptină-grelină pot contribui la comportamente alimentare inadecvate și obezitate.
Metabolismul glucidic
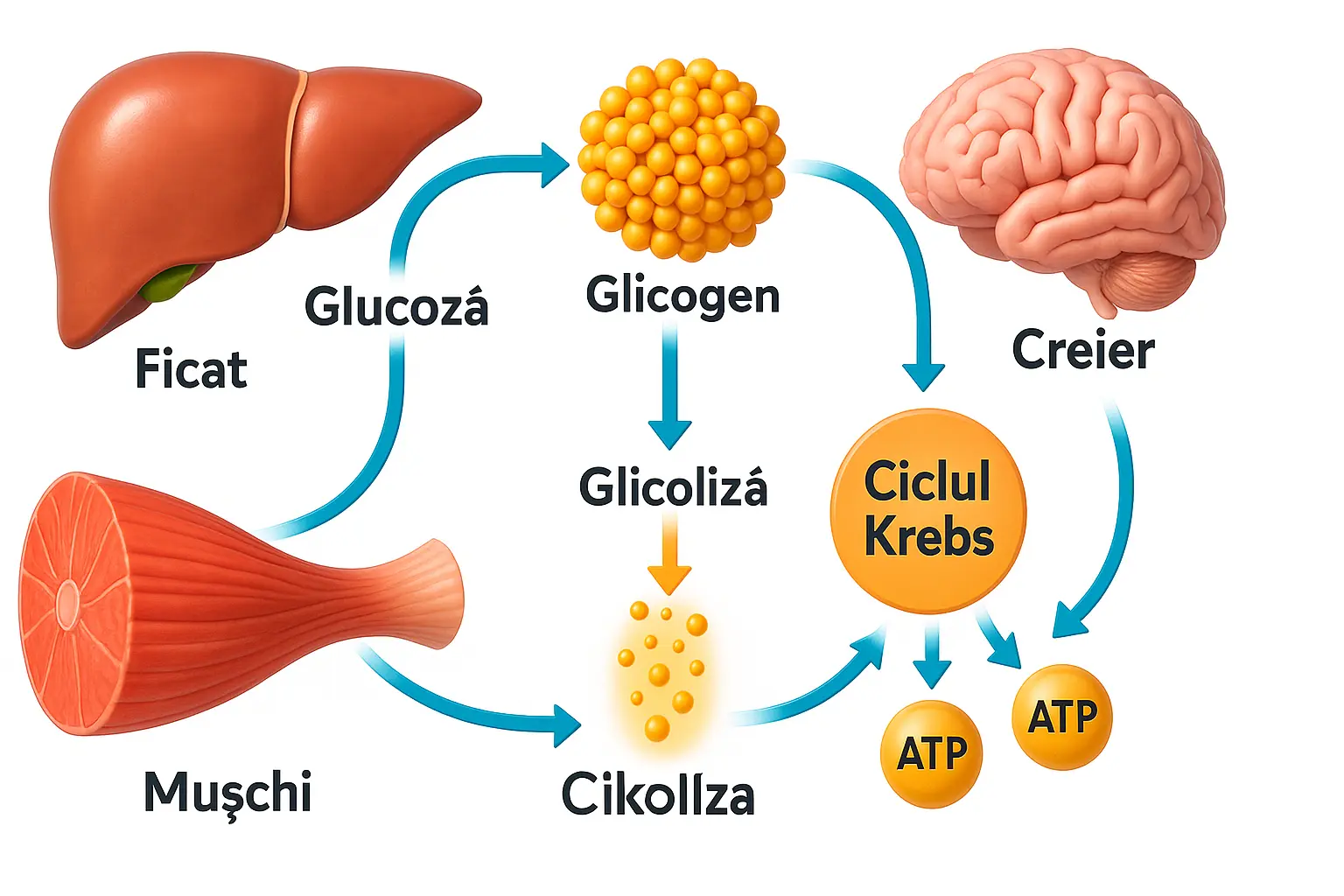
E cunoscut faptul că glucoza este principala și aproape unica substanță nutritivă pentru țesuturile insulinoindependente. Astfel, creierul cu masa de 1400 g și intensitatea circuitului sanguin de 60 ml/100 g de masă consumă pe minut 80 mg glucoză, adică circa 115 g în 24 ore. Ficatul, sediul principal de sinteză al glucozei (numai o parte neconsiderabilă de glucoză se formează în rinichi și mușchi), este capabil să genereze această substanță cu viteza de 130 mg/min.
Deci, 60% din toată glucoza formată în ficat este utilizată pentru asigurarea activității normale a (sistemului nervos central) SNC, această cantitate rămânând constantă nu numai în hiperglicemie, dar chiar și în coma diabetică. Asimilarea glucozei de către SNC se micșorează numai atunci când nivelul ei în sânge scade sub 1,65 mmol/1 (30 mg%).
În organismul omului și animalului, glucoza absorbită din tubul digestiv se transformă în glicogen — polimer al glucozei cu masă moleculară mare. La sinteza unei molecule de glicogen participă de la 2000 până la 20000 molecule de glucoză.
Formarea glicogenului din glucoză începe cu procesul de fosforilare a ei cu ajutorul enzimelor glucokinazei (în ficat) și hexokinazei (în alte țesuturi), formându-se glucozo-6-fosfat (G-6-P) cu conversia ulterioară în glucozo-1-fosfat (G-l-P) și în uridindifosfogluco-ză (UDPG). Ulterior, cu ajutorul enzimelor de polimerizare, se formează structuri cu catene lungi «ramificate» (cu catene laterale) ale glicogenului.
Sinteza glicogenului are loc cu participarea câtorva enzime.
Conversia G-6-P în G-l-P și reacția inversă sunt controlate de enzima fosfoglucomutaza; formarea uridindifosfoglucozei se desfășoară cu participarea UDPG-piro-fosforilazei, a glicogenului — cu participarea glicogensintetazei (uridin-difosfoglucoziitransferazei), iar a structurii «ramificate» a glicogenului — sub influenta enzimei glicogenoramificate (a-l, 4-glican; a-l, 4-glican-6-glicozil transferazei).
Sinteza glicogenului este numită glicogenogeneză, iar scindarea — glicogenoliză.
La procesul de eliberare a glucozei din glicogen participă câteva enzime. Enzima cheie este fosforilaza. Sub influența AMPc și fosforilazkinazei, fosforilaza se transformă din formă inactivă în cea activă. Această formă eliberează din glicogen G-l-P, care prin intermediul fosfoglucomutazei se transformă în G-6-P.
Ambii monofosfați, după defosforilare (respectiv, de către enzimele glucozo-l-fosfatază și glucozo-6-fosfatază), se transformă în glucoză. Glucoza se obține și direct din glicogen, cu ajutorul enzimelor ce desprind catenele laterale ale acestuia (a-l,6-transglicozidaza).
Oxidarea G-6-P se efectuează pe calea glicolizei (ciclul Embden-Me-yerhof) în condiții anaerobe. Ciclul glicolitic al metabolismului glucozei se încheie cu formarea acidului piruvic, convertit apoi în mitocondrii în acid lactic în prezența oxigenului, piruvatul se decarboxilează în acetil-CoA. Această transformare este controlată de enzima piruvatdehidrogenaza, activitatea căreia este inhibată de acetil-CoA (competitiv cu CoA).
Deci, în reglarea activității piruvatdehidrogenazei o importantă deosebită revine conținutului cantitativ al acizilor grași și corpilor cetonici, la oxidarea cărora raportul cantitativ al acetil-CoA și CoA se schimbă în favoarea primei.
Metabolismul fructozei de asemenea se efectuează pe calea glicolitică. O parte din fructoză se transformă în glucoză, iar o altă parte, sub influența cetohexokinazei, în fructozo-1-fosfat și apoi în dihidroxiacetonfosfat, modificările ulterioare ale căreia au loc în ciclul glicolitic.
Acetil-CoA (produs al decarboxilării oxidative a piruvatului), formată în urma glicolizei în ciclul Embden-Meyerhof, se oxidează până la apă și bioxid de carbon în ciclul Krebs (ciclul acidocitric). Acest proces decurge prin opt reacții enzimatice consecutive, în urma cărora se elimină energie. La scindarea totală a unei molecule de glucoză se formează 38 molecule de ATP, dintre care 24 în ciclul Krebs.
Enzimele acestui ciclu sunt localizate în matricea mitocondriilor (în peretele membranei interne). Acetil-CoA provenită din ciclul Krebs este un produs final nu numai al catabolismului glucidelor, dar și al lipidelor, precum și al unor astfel de aminoacizi, ca fenilalanina, tirozina, leucina, izoleucina.
Există și calea directă de oxidare a glucozei — ciclul hexozomonofosfatic (pentozic), care predomină în eritrocite, gonade, corticosuprarenale, ficat. Deși oxidarea în ciclul hexozomonofosfatic constituie numai 2% din metabolismul glucidic (în diabetul zaharat se poate mări până la 6%), importanța acestui ciclu pentru organism este foarte mare.
El asigură formarea pentozelor, acumularea NADP-H, — coenzimei dehidrogenazelor participante la sinteza acizilor nucleici, colesterolului, acizilor grași, activizarea acidului folie și formarea ATP. Ciclul hexozomonofosfatic asigură de asemenea procesele de hidroxilare, necesare pentru sinteza aminelor biogene (catecolaminele, serotonina) și a hormonilor steroizi corticosuprarenal i.
Lanțul reacțiilor consecutive ale ciclului pentozic conduce la formarea ribulozo-5-fosfatului, utilizat la sinteza nucleotidelor sau transformarea printr-o serie de reacții reversibile în hexozomonofosfați, necesari în ciclul giicolitic.
Pe măsura epuizării rezervelor de glicogen, glucoza poate fi resinteti-zată din acid lactic (lactat), aminoacizi și alți compuși. Acest proces este numit gliconeogeneză. Formarea glucozei din lactat are loc în ficat ciclul Cori. Astfel, din lactat se formează piruvat, apoi G-6-P, care se transformă în glicogen sau glucoză, în funcție de starea metabolismului în organism.
Un loc aparte în procesele gliconeogenezei aparține așa-numitului ciclu al alaninei, care se derulează în țesutul muscular. în inaniție, ca consecință a catabolismului proteinelor, se eliberează aminoacizi, peste 50% din cantitatea totală a cărora o alcătuiește alanina. Pătrunsă în ficat, ea nu este utilizată la sinteza proteinelor, ci pentru formarea G-6-P prin stadiul piru-vatului. O oarecare cantitate de alanină, de asemenea prin stadiul piruvatu-lui, se transformă în G-6-P direct în țesutul muscular. în mușchi alanina se formează din acid piruvic; donatorii principali de grupe NH, sunt astfel de aminoacizi ca leucina, izoleucina, valina.
Glicerina, care se formează în metabolismul lipidic, precum și unii componenți ai ciclului Krebs, acidul citric, acidul cetoglutaric și într-o măsură mai mare acidul acetic, de asemenea servesc drept surse pentru resinteza glucozei.
Paralel cu glucoza, o mare importanță în asigurarea energetică a organismului revine grăsimilor. în înfometare, cheltuielile energetice sunt, în fond, acoperite pe contul grăsimilor, glucoza păstrându-se pentru aprovizionarea cu energie a creierului. Acizii grași suprimă asimilarea glucozei în mușchi.
În hipoglicemie are loc mobilizarea acizilor grași și creșterea oxidării lor în mușchi; simultan, are loc diminuarea utilizării glucozei. Și invers, aportul de glucide și creșterea nivelului glucozei în sânge scade lipoliza și sporește lipogeneza. Acest ciclu glucoză - acizi grași este unul din mecanismele ce asigură homeostaza glucozei. Concentrația corpilor cetonici, care reflectă metabolismul lipidic, are, după cum s-a menționat, atribuție directă la reglarea concentrației glucozei în sânge.
Acetil-CoA, fiind produsul final al ciclului giicolitic, poate fi utilizată ca sursă de energie (în ciclul Krebs). Ea, de asemenea, participă la sinteza trigliceridelor, colesterolului și steroizilor, la formarea corpilor cetonici.
Locul central în reglarea hormonală a homeostazei glucozei în organism revine insulinei, sub influența căreia se activizează enzimele fosfori-lării glucozei (glucochinaza în ficat și hexokinazele în țesuturile muscular, adipos și în alte țesuturi), care catalizează formarea G-6-P. Majorarea cantității acesteea mărește activitatea căilor metabolice, pentru care ea este un produs inițial (ciclul hexozomonofosfatic și glicoliza anaerobă). Insulina mărește proporția participării glucozei în procesele de formare a energiei la un nivel constant de producere a energiei.
Activarea de către G-6-P și insulină a glicogensintetazei și a enzimei glicogenoramificate sporește sinteza glicogenului. Paralel cu aceasta, insulina exercită acțiune inhibitoare asupra glucozo-6-fosfatazei hepatice și frânează astfel ieșirea glucozei libere în sânge. Rezultatul final al acțiunii insulinei este hipoglicemia, care stimulează secreția hormonilor antagoniști ai insulinei, din care fac parte adrenalina și noradrenalina, glucagonul, STH, glucocorticoizii, hormonii tiroidieni, numiți și „hormoni de contrareglare*.
In insuficiența insulinică relativă sau absolută sunt dereglate procesele penetrării glucozei în țesuturile insulinodependente, se semnalează diminuarea fosforilării oxidative și formarea G-6-P cu perturbarea ulterioară a căii glicolitice de oxidare a glucozei, dereglarea ciclului Krebs și a ciclului hexozomonofosfatic (pentozic), suprimarea sintezei glicogenului și intensificarea glicogenolizei.
Catecolaminele activează glicogenoliza în ficat și în mușchi. Majorarea sintezei sub influența catecolaminelor (în măsură mai mare, a adrenalinei) activează fosforilaza hepatică, descompunerea glicogenului și formarea unei cantități mari de glucoză liberă. Totodată, sporesc captarea oxigenului și cheltuielile energetice în legătură cu intensificarea activității cardiace, majorarea tonusului muscular și oxidării acidului lactic în ficat.
Glucagonul, similar adrenalinei, activizează adenilatciclaza, formarea AMPc, fosforilaza, glicogenoliza și ieșirea glucozei din ficat în circuitul sanguin. Această influență este mult mai mare decât la adrenalină. însă glucagonul nu acționează asupra fosforilazei musculare și, prin urmare, nu mobilizează glicogenul muscular. Efectul hiperglicemiant al glucagonului este rezultatul stimulării glicogenolizei și gluconeogenezei hepatice, inducției secreției adrenalinei, frânării difuziunei glucozei în mușchi.
Hormonul de creștere sporește ieșirea glucozei în sângele venelor hepatice, intensifică gluconeogeneza, diminuează direct utilizarea glucozei la periferie, precum și indirect prin intensificarea lipolizei și creșterea concentrației în sânge de acizi grași, care suprimă acțiunea insulinei asupra transportului membranaral glucozei.
Glucocorticoizii stimulează metabolismul proteinelor și procesele de gluconeogeneză, măresc conținutul de glicogen în ficat și. într-o măsură mai mică, în mușchi, micșorează transportul glucozei prin membrană și utilizarea ei periferică. Acțiunea hiperglicemică a ACTH este mediată în fond de glucocorticoizi.
Hormonii enumerați mai sus, precum și TSH, hormonii tiroidieni și cei sexuali influențează metabolismul glucidic și modifică indirect metabolismul lipidic și proteic.
Metabolismul lipidic
Grăsimile prezintă una din principalele surse de energie: 40—50% din energia produsă este asigurată de trigliceride (triacilglicerine), cărora le revin 95% din totalitatea lipidelor. Perioada în-jumătățirii acizilor grași constituie câteva minute.
In intestin grăsimile alimentelor sunt emulsionate în picături extrem de mici cu participarea enzimelor hidrolitice și a bilei. Lipazele specifice, ce acționează pe suprafața acestor picături, hidrolizează trigliceridele, esterii colesterolului și fosfoacilglicerinei până la acizi grași, diacilglicerine, 2-mo-noacilglicerine, glicerină, colesterol, lizofosfatidilcolină.
Aceste substanțe, asociindu-se cu acizii biliari, formează micele mixte, dimensiunile cărora sunt de câteva ori mai mici decât dimensiunile particulelor emulsiei.
Astfel de micele sunt absorbite numai de celulele epiteliale ale intestinului subțire, unde părțile constituente ale micelei intră în reacții de sinteză, cu formarea lipidelor simple și compuse.
Lipidele și apoproteinele intestinale formează picături lipidice, numite chilomicroni. Acestea pătrund în vasele limfatice și atribuie limfei un aspect caracteristic laptelui. Limfa, care conține o mare cantitate de chilomicroni, prin duetul toracic drenează în sângele venos. Acizii grași hidrosolubili cu catena carbonică scurtă, precum și o oarecare parte de glicerină sunt reabsorbite prin capilarele sistemului portal.
Ajunse în capilare, trigliceridele, sub influenta lipazei lipoproteice, se hidrolizează în glicerină și acizi grași, iar ultimii pătrund ușor în țesuturile periferice (lipaza lipoproteică plasmatică se deosebește de lipaza hormo-nosensibilă intracelulară). în tubul digestiv, prin intermediul proceselor descrise mai sus, sunt reabsorbite numai 40% din colesterol și peste 85% din trigliceridele ingerate cu alimentele.
După cum am menționat, în urma metabolismului glucidic se formează acetil-CoA, ATP, NADP-H2 și glicerol-3-fosfat, care se utilizează în sinteza grăsimilor, iar cantitatea lipidelor acumulate în depozitele adipoase de rezervă este determinată mai ales de conținutul în rația alimentară a glucidelor și mai puțin de cantitatea grăsimilor.
Lipogeneza prezintă un proces de sinteză a acizilor grași de novo, care decurge intens în ficat și în țesutul adipos. Biosinteza lipidelor ca atare are loc în citoplasmă celulei și numai o mică parte a ei, după cum afirmă unii autori, în mitocondrii.
Acetil-CoA formată în mitocondrii este capabilă de a penetra prin membranele lor în citosol numai după interacțiunea cu oxaloacetatul și formarea citratului, care ajunge în citosol, unde se retransformă în acetil-CoA și oxaloacetat. Deci, oxaloacetatul exercită rolul de catalizator, favorizând transferarea grupului acetilic din spațiul intramitocondrial în citosol, unde cu participarea enzimei acetil-CoA, carboxilazei are loc carboxilarea ace-til-CoA cu formarea de malonil-CoA.
Etapa de carboxilare a acetil-CoA este un reglator important al sintezei acizilor grași; în toate etapele următoare ale lipogenezei participă fie malo-nil-CoA, fie acetil-CoA. Astfel, sub influența sintetazei acizilor grași și cu utilizarea unei molecule de acetil-CoA, se formează palmitil-CoA, capabilă la diverse transformări metabolice.
La pierderea unei molecule de CO2 și CoA, se formează acidul palmitic, care include 16 atomi de carbon. Prin alungirea lanțului carbonic până la 18 atomi de carbon, în mitocondrii sau în rețeaua endoplasmatică acidul palmatic poate fi transformat în acid stearinic, iar su-punându-se desaturării, tot el se transformă în acizii palmitoleic și oleic.
Acizii grași, esterificându-se cu glicerina, formează trigliceridele. în reacția de esterificare participă nu glicerina liberă, ci derivatul ei giicerol-3-fosfatul, format în ficat din glicerină cu participarea enzimei gliceroki-nazei. Esterificarea acizilor grași în țesutul adipos poate avea loc numai în cazul unui aport suficient de dehidroxiacetonfosfat, care se formează în procesul glicolizei și se convertește în glicerol-3-fosfat cu participarea glicerolfosfatdehidrogenazei.
Insulina, atât în ficat, cât și în țesutul adipos, intensifică sinteza acizilor grași și a trigliceridelor. Pe lângă glucoză, în biosinteza endogenă a trigliceridelor pot fi utilizați compuși ce provin din aminoacizi glicogenici. Lipogeneza hepatică este controlată de hormonul tireotrop și hormonii tiroidieni. Astfel, după hipofizectomie, sinteza hepatică a lipidelor se diminuează, restabilindu-se după administrarea tiroxinei.
Lipoliza este procesul de hidroliză a lipidelor cu formarea de acizi grași neesterificați și glicerină. Ea este catalizată de lipaza hormonodependen-tă intracelulară, care acționează asupra trigliceridelor fiind stimulată de AMPc. Lipaza limitează viteza lipolizei, iar formarea AMPc sub influența adenilatciclazei este controlată de diferiți hormoni.
Membrana adipocitelor conține receptori ce interacționează cu hormonii posesori de proprietăți lipolitice (catecolaminele, ACTH, STH etc.), precum și receptori la insulină. în urma acțiunii hormonilor lipolitici sporește activitatea adenilatciclazei, se intensifică formarea AMPc, se activizează lipaza lipoproteică si lipoliza grăsimilor. Interacțiunea insulinei cu receptorii respectivi din contra, suprimă adenilatciclaza, conduce la diminuarea concentrației A MP și la frânarea lipolizei.
Lipoliza se accelerează la înfometare, muncă de lungă durată, hipotermie, stres. Acțiunea lipolitică a catecolaminelor (adrenalinei și noradrenalinei) și a glucagonului are loc prin activizarea adenilatciclazei. Din punct de vedere fiziologic, rolul noradrenalinei în procesul lipolizei se consideră mai important decât cel al adrenalinei. Noradrenalina se formează în terminațiile adrenergice din țesutul adipos și asigură mobilizarea acizilor grași.
Hormonul de creștere exercită o acțiune lipolitică puternică, mecanismul căreia diferă de cel al catecolaminelor. Administrarea hormonului de creștere provoacă majorarea concentrației acizilor grași liberi în plasmă nu îndată, ci peste 2—3 ore. Această acțiune, proprie chiar și unor doze neînsemnate de STH, este, probabil, determinată de diminuarea procesului de reesterificare a acizilor grași liberi. Totuși, STH exercită o anumită influență de modulație și asupra activității adenilatciclazei.
Alți hormoni hipofizari (ACTH, TTH, hormonul melanocitostimulator) de asemenea exercită acțiune lipolitică, deși mai puțin pronunțată decât STH. Majoritatea autorilor consideră că această acțiune are loc prin activarea adenilatciclazei și creșterea vitezei de formare a AMPc.
Hormonii tiroidieni și corticosteroizii exercită acțiune permisivă asupra lipolizei, fiindcă acțiunea lipolitică și calorigenă a catecolaminelor nu se manifestă în absența corticosteroizilor și hormonilor tiroidieni. Totodată, există date precum că TSH, ACTH, și, respectiv, hormonii tiroidieni și corticosu-prarenali induc sinteza de novo a adenilatciclazei și, prin urmare, participă nemijlocit la stimularea lipolizei.
Pe lângă aceasta, hormonii tiroideni influențează activitatea enzimei acetil-CoA-sintetazei, localizată în mitocondrii, și asupra enzimei glicerolfosfatdehidrogenazei, care se află în citosol. Aceste enzime participă atât la reglarea vitezei lipolizei, cât și a lipogenezei.
După cum s-a menționat deja, insulina posedă proprietate antilipoli-tică caracteristică. De aceea, în diabetul zaharat, ca consecință a sporirii lipolizei, concentrația acizilor liberi grași în plasmă crește. Insulinoterapia contribuie la normalizarea nivelului lor.
Metabolismul proteic
Proteinele sunt componentul necesar al oricărui țesut al organismului. Ele nimeresc în organism cu alimentele și în tubul digestiv sunt hidrolizate sub acțiunea enzimelor (pepsina, tripsina) până la peptide nu prea mari și aminoacizi, absorbiți în sânge și limfa.
In organismul uman, pentru sinteza purinelor, pirimidinelor, porfirinelor, sunt utilizați numai aminoacizii. De aceea, toate proteinele administrate cu alimentele trebuie disociate prin diferite reacții enzimatice până la aminoacizi separați, utilizați la sinteza proteinelor organismului propriu.
Unii aminoacizi pot fi sintetizați în organism și de aceea se numesc substituibili, iar alții nu pot fi sintetizați de novo și se numesc insubstituibili. La ultimii se referă leucina, izoleucina, valina, lizina, metionina, fenilala-nina, triptofanul, treonina, histidina și arginina (histidina și arginina se sintetizează în organismul omului matur).
Alanina, acidul asparagic, cisteina, acidul glutamic, glicerina, prolina, serina, tirozina, asparagina și glutamina sunt aminoacizi substituibili.
Sinteza proteinelor este un proces complex, care se derulează permanent. Informația despre structura oricărei proteine a organismului dat se păstrează în cromozomi sub formă de cod genetic.
în cazul sosirii semnalului despre necesitatea sintezei unei anumite proteine, de pe sectorul de ADN, pe care este codificată structura proteinei date, începe copierea informației - sinteza moleculei de ARNm. Procesul de formare a ARN poartă numirea de transcripție. Dacă molecula de ADN este relativ stabilă, atunci perioada de înjumătățire a ARN constituie de la2 până la 80 ore, adică echivalează cu timpul necesar pentru sinteza proteinei.
ARNm format părăsește nucleul și se îndreaptă spre ribozomi, unde se efectuează sinteza proteinei. Pe ribozomi se localizează ARN ribozomal (ARNr) și ARN de transport (ARNt), care împreună participă la procesul de transcriere a informației încadrate în ARNm și de asamblare a proteinei noi. De regulă, ARNr și metionil-ARN( se fixează de un punct special al ARNm, și din acest moment începe mișcarea lor de-a lungul moleculei de ARNm, în timpul căreia se «identifică» codoanele triplete și începe «asamblarea» lanțului polipeptidic al proteinei noi.
Aminoacizii pot fi folosiți de ribozomi numai după activarea lor de către enzimele respective, numărul cărora, probabil, nu este mai mic de 20 (conform numărului aminoacizilor).
Hormonii influențează viteza de sinteză a proteinei pe mai multe căi: prin creșterea sau scăderea activității enzimelor ce participă la procesul de «asamblare» a moleculei proteice, prin modificarea transportului aminoacizilor necesari pentru sinteza proteinei, prin sporirea activității și vitezei formării ribozomilor ce efectuează sinteza proteinei, prin creșterea vitezei de inițiere a formării polizomilor, prin creșterea activității ARN-polimera-zei și vitezei formării ARN .
Unele substanțe pot inhibă, într-o măsură sau alta, procesele enumerate. Astfel, actinomicina, legându-se cu ADN, suprimă sinteza ARNm și astfel stopează acțiunea hormonilor asupra proceselor de transcripție. Piromicina anihilează sinteza proteinelor, influențând asupra ARNt, și inhibă reglarea hormonală a proceselor de translație.
Paralel cu procesele de sinteză a proteinelor, în organism decurg permanent procesele catabolismului proteic, produsul final al căruia la om este ureea.
Amoniacul, format în majoritatea celulelor în procesul de catabolizare a aminoacizilor, paralel cu alte substanțe ce conțin azot se transformă în ficat în uree, procesul având loc în ciclul Krebs-Ghenzeleyt. Amoniacul este transportat în ficat sub formă de glutamină, formată cu participarea glutamatului și a enzimei glutaminsintetazei. în mitocondriile hepatice, glutamina disociază cu participarea glutaminazei în amoniac și glutamat. Ultimul se întoarce în țesut, iar amoniacul este utilizat la formarea carba-moilfosfatului în prezența enzimei carbamoilfosfatsintetazei.
O altă enzimă mitocondrială cu rol cheie în procesul inițial de bio-sinteză a ureei este omitincarbamoiltransferaza, care catalizează formarea citrulinei din carbamoilfosfat și omitină. Citrulina este transportată prin membrana mitocondrială în citosolul celulei, unde, cu participarea enzimei argininosuccinatsintetazei, interactionează cu aspartatul și formează argi-ninosuccinat, care sub acțiunea argininosuccinatliazei disociază în arginină și fumarat.
Arginină, cu ajutorul enzimei arginaza, se descompune în uree și omitină, ultima fiind retransportată în mitocondrii, incluzându-se aici într-un nou ciclu de formare a citrulinei. Pentru formarea unei molecule de uree, în ciclul Krebs-Ghenzeleyt sunt utilizate 4 molecule de ATP.
în funcție de căile de catabolizare, aminoacizii se subdivizează în glucogenici, cetogenici și cu acțiune mixtă. Un aminoacid cetogenic este leucina, care se descompune în acid acetoacetic și acetil-CoA, ambii provocând creșterea nivelului corpilor cetonici în sânge.
Izoleucina, lizina, fenilalanina și tirozina sunt aminoacizi glucogenici și cetogenici. Ultimii doi aminoacizi se descompun în fumarat și acetoacetat, putând fi utilizați în procesele de gluconeogeneză.
Din aminoacizii glucogenici fac parte alanina, arginina, acidul aspa-ragic, cisteină, cistina, acidul glutamic, glicina, histidina, hidroxiprolina, metionina, prolina, serina, treonina, triptofanul, valina. Produsele descompunerii acestor aminoacizi participă la procesele de gluconeogeneză.
Conținutul aminoacizilor în serul sanguin se menține permanent la un anumit nivel pe contul aportului lor din tubul digestiv și depozite, adică din ficat și mușchi. Mușchii conțin peste 50% din toți aminoacizii liberi din organism. Cei mai mobili sunt alanina și glutamina, ei constituind 50% din aminoacizii eliberați din mușchi. Alanina este sintetizată de novo în mușchi prin transaminarea piruvatului. O mare parte din glutamină pătrunde în rinichi, unde azotul scindat este folosit pentru formarea amoniacului.
Alanina este reținută în ficat, unde are loc conversiunea imediată a ei în glucoză prin formarea piruvatului. Procesul a primit numirea de ciclul ala-ninei și, paralel cu ciclul lactatului (ciclul Cori), are o importanță deosebită în procesele de gluconeogeneză.
Sistemul endocrin participă la reglarea metabolismului proteic atât direct, cât și indirect prin influența primară asupra metabolismului glucidic, lipidic și mineral.
în funcție de influența lor asupra metabolismului proteic, toți hormonii pot fi subdivizați în două grupe mari: a) hormoni acțiunea primară a cărora, stimularea proceselor de transcripție, se manifestă în nucleul celulei (steroizii și hormonii tiroidieni); b) hormoni ce stimulează procesele de transcripție, efectuate în citoplasmă celulei.
Acțiunea anabolică a insulinei constă în stimularea transportului aminoacizilor prin membrana celulară și includerea lor în proteine, ceea ce conduce la diminuarea nivelului de aminoacizi în sânge. Această acțiune a insulinei nu depinde de sinteza ARN șj nu este suprimată de actinomi-cină.
Insulina inhibă activitatea aminotransferazelor și enzimelor ciclului ureei. Efectul tardiv al insulinei se caracterizează prin creșterea activității ARN-polimerazei și majorarea concentrației de ARN în ficat. Totodată, se mărește viteza formării polizomilor și ribozomilor.
Acțiunea insulinei asupra sintezei proteinelor în ficat este contrară acțiunii glucagonului, care sporește catabolismul aminoacizilor, mobili-zându-i pentru procesele de gluconeogeneză.
Efectul principal al hormonului de creștere este stimularea proceselor anabolice, ceea ce determină accelerarea creșterii scheletului în hiperse-creția acestui hormon. El, ca și insulina, stimulează transportul aminoacizilor și încorporarea lor în proteine, sporește viteza formării polizomilor și ribozomilor, activitatea ARN- polimerazei, cantitatea de ARN în celule, procese ce intensifică sinteza proteinelor.
Hormonul de creștere inhibă activitatea enzimelor ce scindează aminoacizii. STH mărește, de asemenea, nivelul somatomedinelor în serul sanguin. Paralel cu creșterea scheletului, în excesul hormonului de creștere sporește sinteza colagenului în oase, piele, alte organe și țesuturi ale organismului.
Administrarea hormonilor tiroidieni este însoțită de creșterea metabolismului bazai, tahicardie, diminuarea conținutului de glicogen în miocard, creșterea sensibilității la acțiunea lipolitică a adrenalinei. Influența hormonilor tiroidieni asupra metabolismului se manifestă numai peste 48 ore și mai mult, adică mult mai târziu decât acțiunea insulinei și STH.
Intensificarea metabolismului bazai după administrarea hormonilor tiroidieni este o consecință a creșterii numărului și dimensiunilor mitocon-driilor, numărului de ribozomi și conținutului de citocrom în ei, precum și a formării membranei mitocondriale. Activitatea ARN-polimerazei și sinteza ARN (inclusiv, a ARNm) sporesc. Hormonii tiroidieni nu influențează transportul aminoacizilor. Sub acțiunea acestor hormoni crește activitatea enzimelor, inclusiv a glicerolfosfatdehidrogenazei, citocromoxidazei, cito-cromului C, dehidrogenazei NAD-izocitrice.
Estrogenii măresc conținutul de ARN, mai ales în țesuturile-țintă, sporesc cantitatea de proteine, activitatea ARN-polimerazei, viteza de sinteză a ARN. Se consideră că după cuplarea estrogenilor cu proteinele ahistone ale cromatinei nucleare are loc stimularea unei anumite regiuni a genomu-lui și formarea unor varietăți noi de ARN și de proteine specifice (acide).
Această primă fază de acțiune a estrogenilor durează de la câteva minute până la 1 - 2 ore. Proteinele nou-formate influențează asupra creșterii conținutului de ARN, ceea ce conduce la creșterea sintezei proteice. Durata fazei a doua a efectului hormonal este de 4 ore și mai mult.
Acțiunea androgenilor asupra metabolismului proteic este similară acțiunii estrogenilor. Testosteronul și alți androgeni influențează și dezvoltarea țesutului muscular, ameliorând transportarea aminoacizilor și sporind activitatea ARN-polimerazei.
La administrarea dozelor mari de glucocorticoizi, se semnalează diminuarea rapidă a masei musculare, micșorarea vitezei încorporării aminoacizilor în proteinele musculare, lienale și ale țesutului osos. Se observă diminuarea activității ARN-polimerazei, capacității ribozomilor izolați de a capta aminoacizi.
Aceste modificări nu se referă la ficat, unde se evidențiază intensificarea sintezei enzimelor ce participă la procesele de gluconeogeneză și de scindare a aminoacizilor, inclusiv a glucozo-6-fosfatazei, fosfoenolpiruvatcarboxikinazei, piruvatcarboxilazei etc.
Deci, hormonii reglează toate formele de metabolism (glucidic, lipidic, proteic, mineral etc.), menținând homeostaza, care, după cum a stabilit încă Clod Bernard, este o condiție indispensabilă a activității vitale a organismului.
Dezechilibre hormonale și impactul asupra metabolismului
Rezistența la insulină
Rezistența la insulină apare atunci când celulele devin mai puțin responsive la semnalele insulinei, ducând la:
- Nivel crescut de glucoză în sânge
- Creșterea producției de insulină (hiperinsulinemie)
- Stocarea excesivă a grăsimilor, în special în zona abdominală
- Risc crescut de diabet zaharat tip 2 și boli cardiovasculare
Disfuncții tiroidiene
Dezechilibrele hormonilor tiroidieni afectează profund rata metabolică:
- Hipotiroidismul încetinește metabolismul, ducând la oboseală, intoleranță la frig, creștere în greutate și constipație
- Hipertiroidismul accelerează metabolismul, cauzând pierdere în greutate, intoleranță la căldură, anxietate și tahicardie
Sindromul Cushing și excesul de cortizol
Nivelurile cronice ridicate de cortizol pot provoca:
- Rezistență la insulină
- Creșterea glicemiei
- Redistribuirea grăsimii corporale (obezitate centrală)
- Pierderea masei musculare
- Fragilitate osoasă
Dezechilibre hormonale și obezitatea
Obezitatea este adesea asociată cu multiple perturbări hormonale, inclusiv:
- Rezistență la leptină (reducerea sațietății)
- Niveluri crescute de grelină (stimularea apetitului)
- Rezistență la insulină
- Inflamație cronică de grad scăzut
- Dereglări ale ritmului circadian
Strategii pentru optimizarea reglării hormonale a metabolismului

Modificări alimentare
- Adoptarea unei diete mediteraneene - bogată în grăsimi sănătoase, proteine de calitate și carbohidrați complecși
- Limitarea zahărului și carbohidraților rafinați - pentru a preveni fluctuațiile glicemice și insulinemice
- Creșterea consumului de fibre - pentru a îmbunătăți sensibilitatea la insulină și sațietatea
- Alimentație cronobiologică - sincronizarea meselor cu ritmurile circadiene
Activitate fizică regulată
- Antrenamentul de rezistență - pentru creșterea masei musculare și îmbunătățirea sensibilității la insulină
- Exerciții aerobice - pentru optimizarea funcției cardiovasculare și metabolismului lipidic
- Antrenamentul intervalic de mare intensitate (HIIT) - pentru creșterea cheltuielilor energetice și îmbunătățirea metabolismului glucozei
Gestionarea stresului
- Practicarea tehnicilor de relaxare (meditație, respirație profundă)
- Somn de calitate (7-9 ore pe noapte)
- Expunerea la lumină naturală pentru reglarea ritmului circadian
- Limitarea expunerii la perturbatori endocrini din mediu
Suplimente și remedii naturale
- Crom - poate îmbunătăți sensibilitatea la insulină
- Magneziu - important pentru metabolismul glucozei
- Acid alfa-lipoic - antioxidant cu efecte benefice asupra sensibilității la insulină
- Plante adaptogene (ashwagandha, rhodiola) - pot ajuta la reglarea cortizolului
- Scorțișoară - poate îmbunătăți controlul glicemic
Întrebări frecvente despre reglarea hormonală a metabolismului
1. Ce rol are insulina în metabolismul glucozei?
Insulina reglează absorbția glucozei în celule și stimulează stocarea acesteia sub formă de glicogen și grăsimi. Un dezechilibru al insulinei poate duce la rezistență insulinică și diabet de tip 2.
2. Cum influențează hormonii tiroidieni rata metabolică?
Hormonii T3 și T4 accelerează metabolismul bazal, consumul de oxigen și arderea nutrienților. Hipotiroidismul încetinește aceste procese, în timp ce hipertiroidismul le intensifică.
3. Ce impact are cortizolul asupra greutății corporale?
Cortizolul, hormonul stresului, crește nivelul glucozei în sânge și favorizează stocarea grăsimii viscerale. Nivelurile cronice ridicate pot duce la obezitate abdominală și sindrom metabolic.
4. Poate fi influențată secreția de leptină și grelină prin stilul de viață?
Da, alimentația dezechilibrată și somnul insuficient pot reduce eficiența leptinei (hormonul sațietății) și crește nivelul de grelină (hormonul foamei), favorizând supraalimentarea.
5. Ce strategii naturale ajută la echilibrarea hormonilor metabolici?
Adoptarea unei diete antiinflamatorii, exercițiile fizice regulate, somnul de calitate și evitarea stresului cronic contribuie la reglarea hormonală și îmbunătățirea metabolismului.
6. Ce hormoni sunt responsabili pentru creșterea în greutate?
Insulina, cortizolul și estrogenii în exces pot contribui la creșterea în greutate prin promovarea stocării grăsimilor. De asemenea, nivelurile scăzute de hormoni tiroidieni și rezistența la leptină pot încetini metabolismul și crește apetitul.
7. Cum pot detecta un dezechilibru hormonal?
Simptomele comune ale dezechilibrelor hormonale includ oboseală inexplicabilă, modificări ale greutății, probleme de somn, modificări ale apetitului, fluctuații ale dispoziției și probleme digestive. Diagnosticul definitiv necesită analize de sânge și evaluare medicală.
8. Poate alimentația să influențeze echilibrul hormonal?
Da, alimentația are un impact semnificativ asupra echilibrului hormonal. Consumul excesiv de zahăr și carbohidrați rafinați poate perturba sensibilitatea la insulină, în timp ce grăsimile sănătoase și proteinele de calitate pot susține producția optimă de hormoni.
9. Ce rol joacă somnul în reglarea hormonală a metabolismului?
Somnul este esențial pentru echilibrul hormonal. Privarea de somn poate duce la creșterea cortizolului și ghrelinei, scăderea leptinei și rezistență la insulină, contribuind la creșterea în greutate și probleme metabolice.
10. Este posibilă reglarea naturală a hormonilor?
Da, multe persoane pot îmbunătăți echilibrul hormonal prin modificări ale stilului de viață: alimentație sănătoasă, exerciții fizice regulate, gestionarea stresului și somn de calitate. În cazurile severe sau persistente, poate fi necesară intervenția medicală.
Concluzii
Reglarea hormonală a metabolismului reprezintă un sistem complex, cu multiple niveluri de control și interacțiuni. Dezechilibrele în acest sistem pot duce la probleme de sănătate semnificative, inclusiv obezitate, diabet și sindrom metabolic. Adoptarea unui stil de viață sănătos, care include o alimentație echilibrată, activitate fizică regulată și gestionarea eficientă a stresului, poate ajuta la optimizarea funcției hormonale și menținerea unui metabolism eficient.
Înțelegerea modului în care hormonii influențează metabolismul ne permite să facem alegeri informate cu privire la sănătatea noastră și să abordăm problemele metabolice într-un mod holistic, adresând cauzele fundamentale, nu doar simptomele.