Structura şi ultrastructura celulei
- Detalii
- Categorie: Biologie celulară
- Accesări: 28,204
Membrana celulară, cunoscută și sub denumirea de membrană plasmatică, este structura care delimitează celula și controlează schimburile de substanțe dintre celulă și mediul exterior. Aceasta joacă un rol esențial în menținerea homeostaziei și în protejarea organitelor celulare.
Membrana celulară - definiţia şi funcţie
Membranele biologice sunt ansambluri metabolic active, compuse din proteine şi lipide, ce formează structuri continui, cu proprietăţi caracteristice de permeabilitate selectivă, iar prin prezenţa lor se realizează delimitarea periferică şi compartimentarea internă a celulelor eucariote.
Celula este delimitată periferic de membrană plasmică sau plasmalemă, ce separă conţinutul intern celular de mediul extracelular. Ea joacă un rol fiziologic considerabil fiind locul de pasaj obligatoriu al substanţelor ce intră sau ies din celulă, intervenind în controlul schimburilor dintre celulă şi mediul extracelular, recepţionează variaţiile condiţiilor de mediu extracelular prin receptorii de membrană, ce transmit informaţii şi stimuli, contribuind la modularea activităţilor specifice celulei.
Membranele interne sau endomembranele delimitează reticulul endoplasmatic, aparatul Golgi, nucleul, mitocondriile, lizozomii, veziculele exozomi, proteazomii, peroxizomii ş.a.
Structura membranei celulare
Membrana celulară este alcătuită dintr-un bistrat lipidic în care sunt încorporate proteine și alte componente esențiale:
- Fosfolipide – formează bistratul lipidic, având capete hidrofile și cozi hidrofobe.
- Proteine membranare – pot fi integrale sau periferice, având roluri în transport, semnalizare și ancorare celulară.
- Colesterol – prezent în membranele celulelor eucariote, conferă stabilitate și fluiditate.
- Carbohidrați – legați de proteine (glicoproteine) sau lipide (glicolipide), sunt implicați în recunoașterea celulară și comunicare.
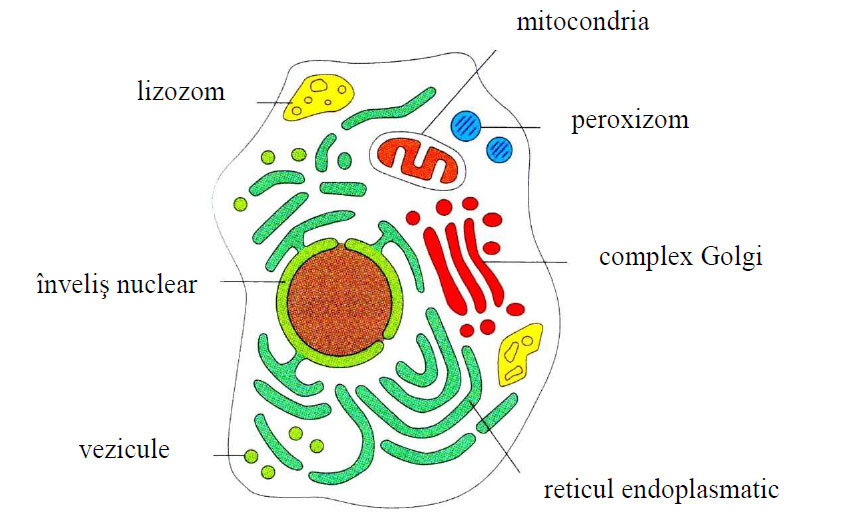
Figura 1 - Endomembranele organitelor unei celule (după Alberts et al., 2010)
Funcțiile membranei celulare
Funcţiile membranelor biologice sunt foarte variate:
- funcţia de barieră este îndeplinită de membrana plasmică şi de endomembrane ce compartimentează celula, asigurând spaţii pentru desfăşurarea reacţiilor metabolice în condiţii optime;
- intervin direct în metabolismul celular prin procesele majore de conversie energetică (fotosinteza în membrana internă a cloroplastelor, iar fosforilarea oxidativă în membrana internă a mitocondriilor);
- controlează fluxul de informaţii dintre celule şi mediul extracelular prin receptorii de membrane specifici pentru stimulii externi;
- îndeplinesc un rol important în procesele de apărare ale celulelor, ţesuturilor, organelor şi ale întregului organism, faţă de agenţi biologici patogeni (microbi, viruşi);
- la nivelul lor se metabolizează anumite substanţe medicamentoase (în membranele reticulului endoplasmatic, ale peroxizomilor, proteazomilor, lizozomilor).
Ultrastructura membranei plasmice
La microscopul electronic, membrana plasmică apare trilaminată, unică, formată din două foiţe întunecate, dense, ce cuprind între ele o foiţă clară, electrono-transparentă. Grosimea fiecărei foiţe este în medie de 2,5-3,5 nm, astfel că grosimea totală a membranei poate fi cuprinsă între 8 şi 10 nm.
S-a stabilit că foiţele dense, externă şi internă, nu au obligatoriu aceeaşi grosime, foiţa internă fiind uneori mult mai groasă, iar membrana în întregime poate să nu fie uniform de groasă pe suprafaţa celulei.
Aspectul trilamelar al membranei plasmice este atât de constant şi de uniform încât se poate considera că reprezintă o structură elementară, numită de Robertson [1966] ”unit-membrane” (unitate de membrană). Acest concept este cunoscut sub numele de ”Teoria unităţii de structură şi de grosime a membranelor”.
În funcţie de aspectele electronomicroscopice, Sjostrand a împărţit membranele biologice în două tipuri ultrastructurale:
- membrana plasmică cu organizare trilamelară;
- membranele endoplasmatice sau citoplasmatice cu organizare structurală globulară(a-citomembranele cu suprafeţe rugoase, fi- citomembranele cu suprafeţe netede şi membranele mitocondriale mai complexe).
Membranele plasmice naturale prezintă grosimi diferite de la o celulă la alta şi chiar în cadrul aceleiaşi celule, realizându-se asimetrii de structură şi de organizare moleculară, care antrenează la nivelul lor particularităţi de funcţie.
Asimetria structurală se observă mai ales la celulele intestinale, pancreatice şi renale, la care membrana plasmică a feţelor laterale ale celulelor este mai subţire decât cea a polului apical prevăzut cu microvili. Astfel, membrana plasmică a polului apical, la celulele intestinale, are un set de proteine ce diferă de cel al membranei laterale sau bazale, aici fiind localizate numeroase enzime ce participă la procesele de digestie.
Dimpotrivă, membrana plasmică a feţelor laterale prezintă un bagaj enzimatic implicat în transportul trans-epitelial. La nivelul polului bazal, proteina enzimă ce predomină este Na- K-ATP-aza, tot aici aflându-se proteine-receptori pentru hormoni sau pentru componentele matricei extracelulare.
Constituenţii biochimici ai membranei plasmice
În urma unor studii complexe, se ştie că membrana plasmică este formată din lipide, proteine şi, în cantitate mai puţin importantă, din glucide.
Lipidele sunt aranjate sub forma unui strat bimolecular continuu. Lipidele membranare sunt în majoritatea lor fosfolipide, dar mai există colesterol şi glicolipide.
Glucidele apar pe suprafaţa tuturor membranelor plasmice ale celulelor eucariote, sub formă de glicoproteine sau glicolipide.
Proteinele constituie suportul molecular al funcţiilor majore îndeplinite de membrane, ele fiind foarte diversificate numeric şi tipologic. Astfel, în teaca de mielină a neuronilor proteinele reprezintă 25% din greutatea totală a moleculelor membranare, în membrana plasmică se găsesc circa 50%, iar în membrana internă a mitocondriilor circa 75%.
Proteinele asigură funcţionalitate membranelor, intervenind în transportul activ de substanţe şi îndeplinind funcţii enzimatice sau de receptori.
În funcţie de localizare şi tip de membrană au fost identificate ca enzime - markeri: 5’-nucleotidaza la nivelul plasmalemei, monoaminoxidaza în membrana externă a mitocondriei, citocromoxidaza şi adenozintrifosfataza în membrana internă a mitocondriei, glucozo-6-fosfataza în membrana reticulului endoplasmatic ş.a.
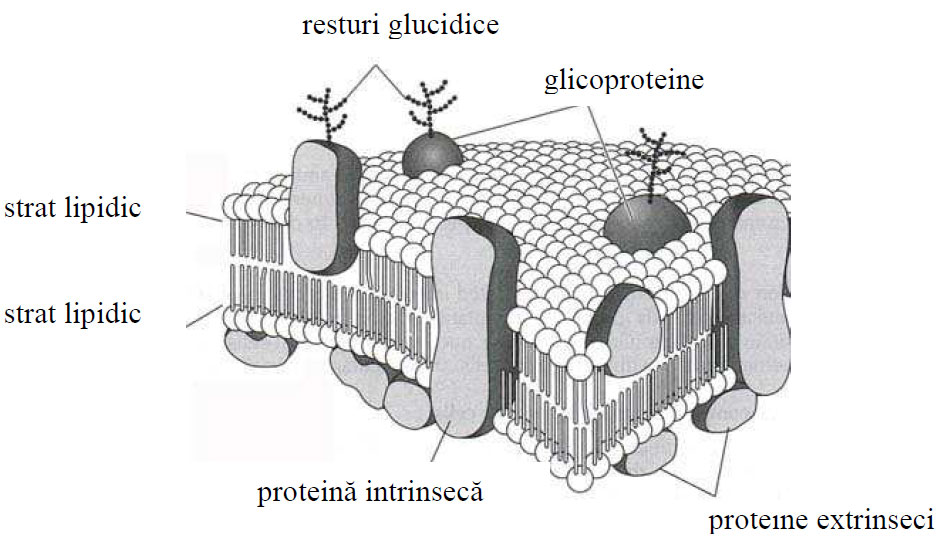
Figura 2 - Schiţa structurii unei membrane biologice (după Henrikson et al, 1997)
Proteinele membranare sunt de două tipuri:
- proteinele intrinseci stabilesc contacte cu bistratul lipidic, unele dintre ele pot să pătrundă doar unul din straturile lipidice, iar altele pot traversa ambele straturi.
- proteinele extrinseci sau periferice sunt localizate pe feţele bistratului lipidic, în unele regiuni putând interacţiona cu grupările polare ale lipidelor sau cu proteinele intrinseci.
Organizarea moleculară a membranelor biologice
Modelul Overton a fost propus de Charles Overton [1890] în urma unor studii pe plante, când a observat că substanţele lipido-solubile au penetrat rapid în celulele vegetale, faţă de substanţele hidrosolubile care nu au penetrat deloc.
Ipoteza lui Overton afirma că lipidele sunt prezente pe suprafaţa celulelor sub formă de „înveliş”, probabil un amestec de colesterol şi lecitină. Această ipoteză s-a dovedit a fi remarcabilă pentru ce ştim în prezent despre proeminenţele de steroli şi de fosfolipide, componenţii de bază ai membranelor celulare.
Modelul Langmuir a fost propus de Irving Langmuir [1910], care a studiat comportamentul fosfolipidelor purificate prin dizolvare în benzen şi etalarea probelor pe o suprafaţă apoasă. Langmuir a observat că fosfolipidele se orientează singure în aşa fel încât capetele lor hidrofile vor fi spre apă, iar cozile hidrofobe se vor aşeza invers evitând apa.
Modelul Gorter-Grendel [1925] susţinea ipoteza lui Langmuir şi a fost prima încercare de a înţelege structura membranelor celulare la nivel molecular. Experimentele lor au dovedit existenţa bistratului lipidic continuu, care a devenit astfel modelul de bază în studiul membranelor biologice.
Modelul Davson-Danielli este considerat cel mai vechi model detaliat de membrană şi care a cunoscut, cu câteva variante, un succes considerabil în timp. După James Danielli şi Hugh Davson [1935] membrana ar fi constituită din două foiţe proteice fibrilare între care se găseşte un strat bimolecular de lipide.
Într-un al doilea model, zis micelar, moleculele de fosfolipide ar fi dispuse astfel încât să formeze micelii globulare, cu extremităţile hidrofobe ale moleculelor de fosfolipide orientate spre centrul miceliilor şi cu extremităţile hidrofile orientate spre exterior, în jurul miceliilor fiind dispuse moleculele proteice.
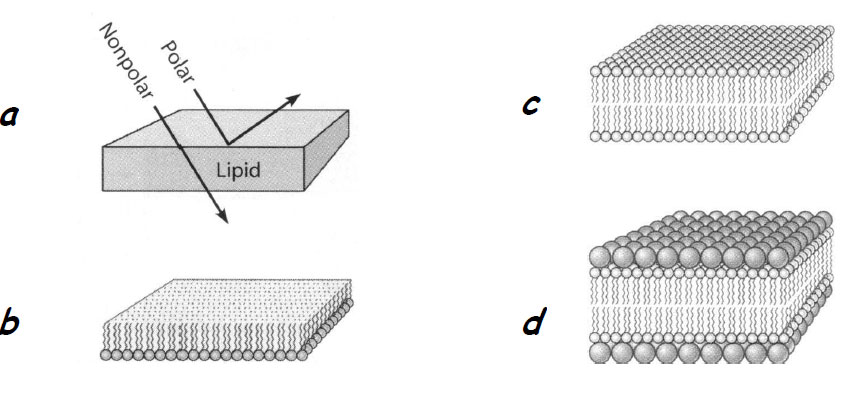
Figura 3 - Modele de membrană: a -modelul Overton; b -modelul Langmuir; c -modelul Gorter-Grendel; d -modelul Davson-Danielli (după Becker et al., 2009)
Modelul Robertson a fost propus de către J. David Robertson [1960], care a observat la microscopul electronic organizarea trilaminară a membranelor celulare, cu aspect de „şine de cale-ferată", adică două linii întunecate separate de o zonă centrală clară, cu o grosime de 6-8 nm. El a mai sugerat că toate membranele celulare au o structură comună, pe care a numit-o ”unit membrane
Modelul Singer-Nicolson a fost propus de Jonathan Singer şi Garth Nicolson în 1972, fiind admis în prezent de marea majoritate a specialiştilor. Ei au reţinut structura de bază din modelele anterioare, dar au observat şi descris proteinele membranare ca entităţi globulare ce se asociază cu structurile hidrofile ale bistratului lipidic prin încorporare sau ataşare. Acest model ţine seama, mai ales, de raportul proteinelor cu stratul bimolecular lipidic (aspect de mozaic fluid lipido-proteic), legat de comportamentul membranei.
Modelul Unwin-Henderson a fost propus de Nigel Unwin şi Richard Henderson în 1975, care au observat la microscopul electronic structura tridimensională a bacteriorhodopsinei şi orientarea ei în membrană. Bacterio- rhodopsina conţine un singur lanţ peptidic ce se pliază de şapte ori pe bistratul lipidic al membranei celulare. În acest studiu, ei au considerat că proteinele trans-membranare sunt ancorate în bistratul lipidic prin unul sau mai multe segmente proteice trans-membranare.
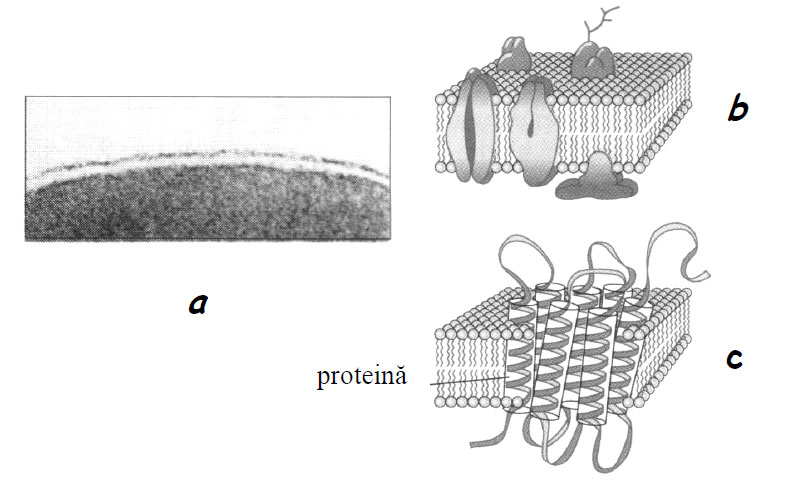
Figura 4 - Modele de membrană: a -modelul Robertson, TEM 110.000x; b -modelul Singer-Nicolson; c -modelul Unwin-Henderson (după Becker et al., 2009)
Mişcările moleculelor de acizi graşi din structura membranelor celulare au fost puse în evidenţă prin studiul rezonanţei electromagnetice după marcarea unui atom de carbon din lanţul acidului gras cu o moleculă de nitroxid. În interiorul fosfolipidelor au fost observate mişcări de flexie ale atomilor de carbon din grupările metilenice ale acizilor graşi, mişcări ale atomilor de carbon din gruparea polară a acizilor graşi.
Au mai fost descrise mişcări ale întregii molecule de fosfolipidă (deplasare laterală, mişcări de rotaţie şi salturi dintr-un strat lipidic în celălalt sau mişcări flip-flop). Proteinele, în mod asemănător, prezintă şi ele o mobilitate dar mai redusă.
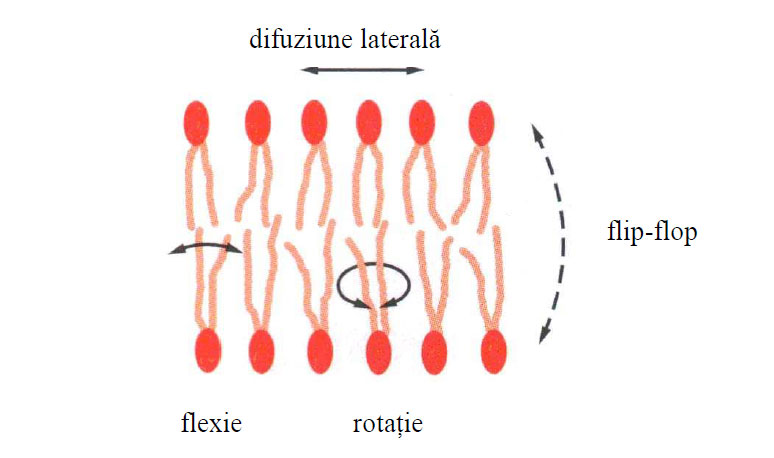
Figura 5 - Mişcări ale moleculelor de fosfolipide la nivel de membrană (după Alberts et al., 2010)
Dinamismul membranelor celulare
Fluiditatea bistratului lipidic
Membranele celulare sunt structuri dinamice, aflate într-o continuă stare tranziţională sub aspect fizico-chimic şi morfo-fiziologic. Caracterul dinamic rezultă din proprietăţile structurale şi funcţionale ale biomoleculelor componente, ele asigurând adaptarea funcţională permanentă a membranelor la stimulii intra- şi extracelulari.
Aşa cum s-a mai spus, introduse într-un mediu apos, fosfolipidele se organizează spontan în structuri sferice (micele) sau plane (dublu strat). In acest fel, regiunile hidrofile ale fosfolipidelor sunt expuse mediului apos, iar regiunile hidrofobe sunt sechestrate în interiorul structurilor formate.
Uneori, structurile cu dublu strat, formate de fosfolipide şi de glicolipide, au tendinţa de a se închide dând naştere unor vezicule sferice, numite lipozomi. Alteori, fosfolipidele se asamblează spontan în dreptul unui orificiu din peretele ce separă două compartimente apoase, formând aşa- numitele membrane negre.
Lipozomii şi membranele negre sunt considerate membrane artificiale.
Fluiditatea este o caracteristică generală tuturor membranelor biologice, menţinerea ei fiind un factor esenţial în desfăşurarea normală a proceselor celulare.
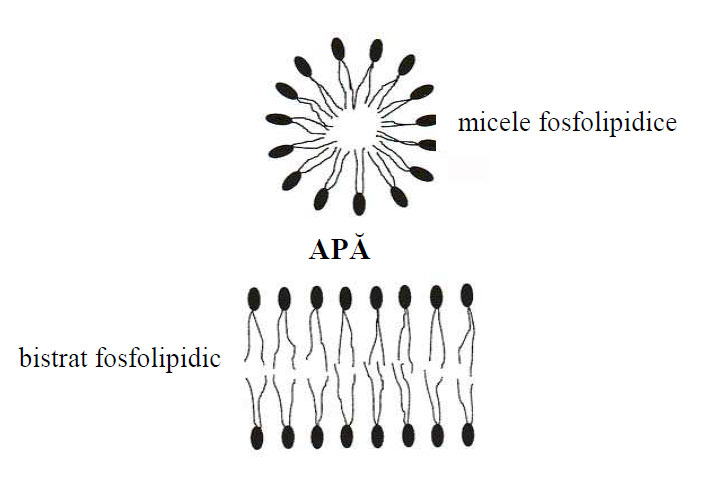
Figura 6 - În mediu apos, fosfolipidele se organizează spontan în micele sau bistrat lipidic (după Voiculeţ and Puiu, 1997)
O serie de studii efectuate pe membrane artificiale cu un singur tip de fosfolipid, au demonstrat că la o anumită temperatură(temperatură critică) are loc tranziţia de fază , adică trecerea bistratului lipidic din stare fluidă în stare de gel. În tranziţia de fază, moleculele tind să-şi abandoneze conformaţia neordonată şi să se organizeze într-un mod ordonat, superior.
În bistraturile lipidice artificiale, ce conţin fosfolipide cu diferite grade de nesaturare, apare faza de separare prin agregarea spontană a unui tip de fosfolipide la o valoare a temperaturii critice. În membranele biologice nu a fost posibilă evidenţierea fazei de separare, datorită coexistenţei acizilor graşi saturaţi şi nesaturaţi în structura aceleiaşi molecule lipidice.
Fluiditatea membranei mai este influenţată de conţinutul ei în colesterol. Felul în care colesterolul interacţionează cu fosfolipidele învecinate determină ca o concentraţie mare de colesterol să ducă la scăderea fluidităţii membranei şi la imposibilitatea apariţiei fazei de separare. În acest caz, s-a observat că scade permeabilitatea membranei pentru moleculele de apă, dar creşte considerabil rezistenţa mecanică a structurii membranare.
Molecula de colesterol, datorită dimensiunilor mici ale grupărilor sale polare, se redistribuie rapid în bistratul lipidic prin mişcări tip ’’flip-flop". Această mobilitate a colesterolului conferă membranelor caracterul de flexibilitate, de schimbare a formei.
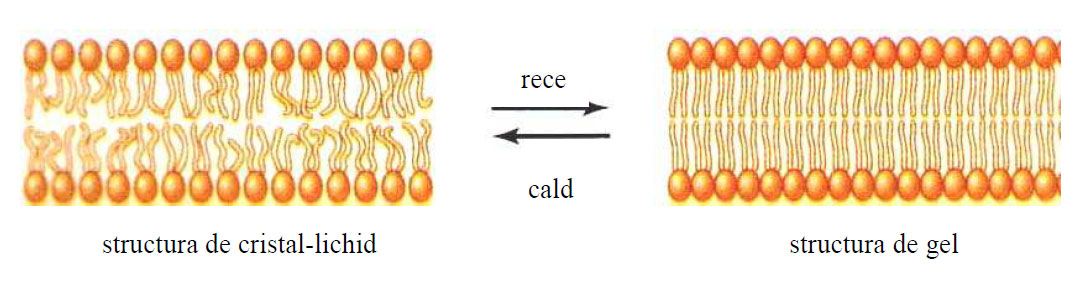
Figura 7 - Fluiditatea membranei (după Moyes and Schulte, 2008)
Gangliozidele
Gangliozidele influenţează şi ele fluiditatea membranei. Capacitatea lor de a participa la formarea legăturilor de hidrogen determină creşterea gradului de ordonare a membranei şi, implicit, accentuarea rigidităţii ei, conferind stabilitate celulelor supuse stress-ului mecanic.
Din cele expuse, reiese că fluiditatea este o caracteristică generală tuturor membranelor biologice, menţinerea ei fiind un factor esenţial în desfăşurarea normală a proceselor celulare.
Mobilitatea componentelor membranare
Studiul mobilităţii biomoleculelor din membrane a fost efectuat atât pe modele de membrane artificiale strict lipidice, cât şi pe modele în care au fost inserate molecule proteice. Rezultatele studiului au fost apoi verificate pe membrane biologice izolate şi pe hematii intacte, cu ajutorul unor lipide şi proteine marcate.
S-a observat că lipidele şi proteinele au fost capabile să execute diferite tipuri de mişcări în interiorul membranei: difuzia laterală, difuzia rotaţională şi difuzia transversală (inversiune sau flip-flop).
Asimetria distribuţiei componentelor membranare
Distribuţia asimetrică a componentelor lipidice pe cele două feţe ale bistratului membranar a fost pusă în evidenţă pentru prima dată în membranele hematiilor. S-a constatat că monostratul extern conţine mai ales fosfatidilcolină şi sfingomielină, iar cel intern conţine, drept componente lipidice majore, fosfatidiletanolamina şi fosfatidilserina.
Explicaţia asimetriei în distribuţia lipidelor membranare constă în difuzia transversală a acestor molecule, catalizată de fosfatidiltranslocază la nivelul membranei reticulului endoplasmatic neted, în cursul procesului de sinteză a lipidelor celulare.
La nivel funcţional, implicaţiile asimetriei lipidelor nu sunt încă pe deplin cunoscute. Se presupune că activitatea diferitelor proteine membranare ar fi dependentă de microdomeniul creat de prezenţa fosfolipidelor specifice. Înacelaşi timp, activitatea enzimatică a proteinelor asociate structurilor membranare ar putea fi condiţionată de încărcarea electrică a fosfolipidelor.
În multe celule, distribuţia asimetrică a componentelor membranare determină delimitarea unor domenii specifice ale plasmalemei. Astfel, în celulele epiteliale membranele sunt împărţite în două domenii distincte:domeniul apical şi cel latero-bazal.
Fiecare din cele două domenii are un conţinut proteic şi lipidic diferit, ceea ce demonstrează că, celulele epiteliale sunt capabile să împiedice difuzia moleculelor membranare prin intermediul joncţiunilor strânse, cu rol de barieră între cele două domenii.
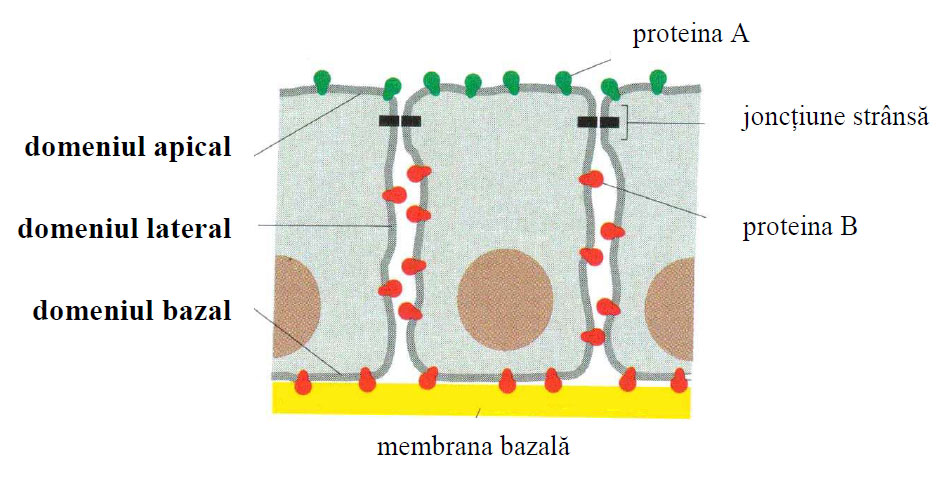
Figura 8 - Domeniile membranare ale celulei (după Alberts et al., 2010)
Glicocalixul
Reprezintă zona periferică a suprafeţei celulare, iar în structura sa intră atât lanţurile oligo- şi poliglucidice ale glicolipidelor şi glicoproteinelor de membrană, cât şi glicoproteinele şi proteoglicanii sintetizaţi de celulă şi apoi adsorbiţi pe suprafaţa ei.
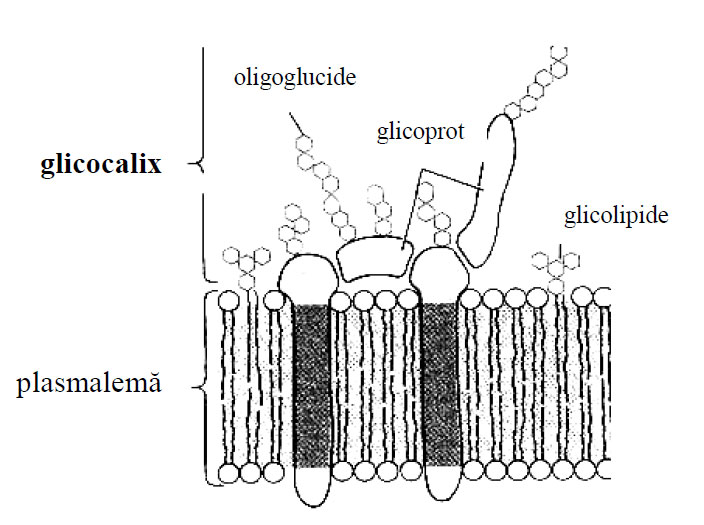
Figura 9 - Reprezentare schematică a glicocalixului (după Darnell et al., 1988)
La microscopul electronic, glicocalixul apare sub forma unor filamente orientate radiar, puternic ataşate de suprafaţa membranei. Filamentele au o grosime de circa 25-50 A (angstromi) şi o lungime de 0,1-0,5 pm, fiecare se ramifică conferind suprafeţei celulare apicale un aspect de reţea.
Glicocalixul este mai gros şi mai bine structurat la suprafaţa celulelor epiteliale intestinale, a pancreasului exocrin şi a tubilor renali în zona microvililor şi este mai subţire în jurul celulelor conjunctive, a celulelor sanguine şi a celulelor din glandele endocrine.
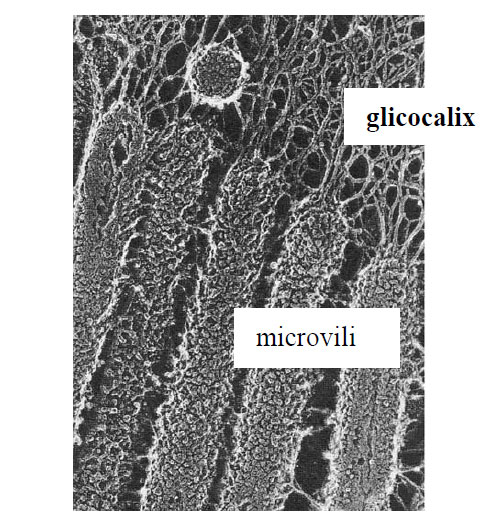
Figura 10 - Microvili celule din epiteliul intestinal, TEM 125.000x (după Darnell et al., 1988)
Rolul principal al glicocalixului este de a interveni în fenomenele de imunitate şi în adezivitatea celulară. Prezenţa glicocalixului pe suprafaţa celulară determină o permeabilitate mai scăzută pentru ioni şi o rezistenţă electrică mai mare.
Receptorii de membrană
Nici o celulă nu trăieşte izolată, ci stabileşte relaţii complexe de comunicaţii cu alte celule. În felul acesta se coordonează creşterea, diferenţierea şi metabolismul diferitelor tipuri celulare din ţesuturi şi organe.
Celulele trebuie, în egală măsură, să comunice şi la distanţă. Pentru acest proces sunt necesari o serie de produşi extracelulari, cu rol de mesageri sau de semnale, care mai poartă denumirea de liganzi. Astfel, o substanţă secretată de celula-semnal este recunoscută printr-un receptor specific (de natură proteică) de o celulă-tintă, în care se va produce un răspuns adecvat.
La plante, animale şi la om semnalele extracelulare controlează creşterea majorităţii ţesuturilor, guvernează sinteza şi secreţia de proteine şi ajustează compoziţia secreţiilor din organism. Practic, aceste semnale extracelulare sunt clasificate în funcţie de distanţa la care acţionează, astfel:
- comunicarea endocrină, când celulele glandelor endocrine secretă hormoni, mesageri ce acţionează asupra unui grup îndepărtat de celule- ţintă; la animale şi om, un hormon este de obicei transportat de la locul de secreţie către ţinta sa prin circulaţia sanguină;
- comunicarea varacrină, când celulele-ţintă supuse efectelor mesagerului sunt adiacente celulei-semnal; de exemplu. conducerea unui influx nervos de la un neuron la altul. de la un neuron la o fibră musculară sau de la un neuron la o celulă glandulară necesită mesageri chimici extracelulari, numiţi neurotransmiţători;
- comunicarea autocrină, când celulele răspund substanţelor proprii de secreţie; o astfel de comunicare. obişnuit. nu se observă decât în stări patologice. cum este cazul celulelor tumorale care sintetizează şi eliberează factori de creştere ce stimulează proliferarea necontrolată şi haotică atât a celulelor tumorale. cât şi a celor normale învecinate.
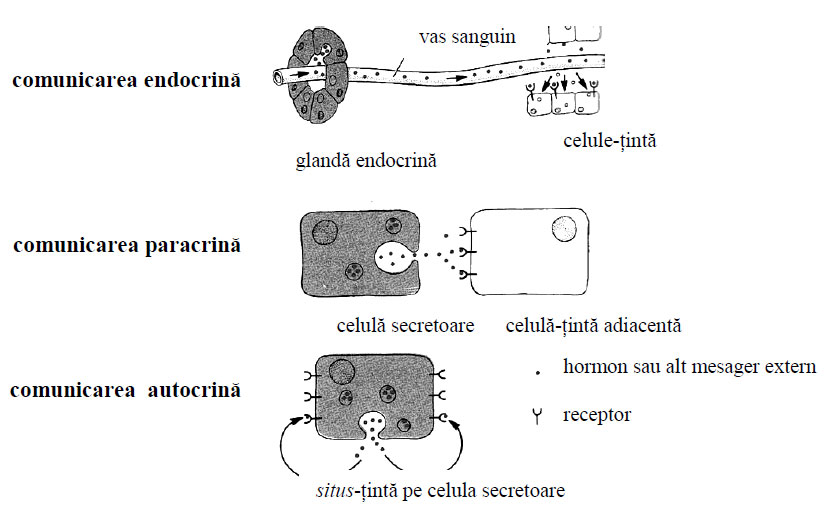
Figura 11 - Semnale extracelulare la celulele animale (după Darnell et al, 1988)
Uneori. aceeaşi substanţă mesager serveşte în două sau trei tipuri de comunicări. De exemplu. adrenalina şi anumite peptide mici servesc simultan ca neurotransmiţători (mesageri paracrini) şi ca hormoni sistemici (mesageri endocrini).
În general comunicarea prin mesageri extracelulari necesită şase etape ce trebuiesc parcurse. astfel:
- sinteza intracelulară.
- secreţia compusului chimic de către celula-semnal.
- transportul mesagerului până la celulele-ţintă.
- detectarea lui (adesea de către un receptor proteic specific).
- transducţia, adică transmiterea semnalului spre aparatul sintezei de proteine din citoplasma celulei-ţintă şi
- răspunsul celulei-ţintă ce constă. în general. din sinteza unei proteine specifice.
Rolul mesagerilor extracelulari în metabolismul celular
Anumiţi mesageri produc o modificare a activităţii uneia sau a mai multor enzime deja prezente în celula-ţintă. Acest tip de reacţie permite celulei să răspundă rapid. în câteva secunde sau minute. Marea majoritate a mesagerilor ce provoacă astfel de schimbări rapide sunt hidrosolubili şi se leagă de receptorii situaţi în membrana plasmică a celulelor-ţintă.
Alte tipuri de molecule de comunicare pot schimba, în primul rând, modul de expresie genică, ele molecule fiind în general liposolubile şi puţin hidrosolubile.
Comparativ cu moleculele hidrosolubile, cele liposolubile induc în celulele lor ţintă răspunsuri mai lente şi de mai lungă durată. Astfel de interacţiuni prelungite sunt determinante în timpul creşterii şi diferenţierii.
Hormonii steroizi, exemplele cele mai cunoscute a acestei clase de molecule, se vor fixa la receptorii intracelulari, ce se leagă la regiunile reglatoare din ADN, provocând inducţia genelor specifice. Mesagerii hormoni pot controla sinteza, secreţia şi degradarea altor hormoni.
Mecanismele complexe de retroactiune
Mecanismele complexe de retroactiune(feedback), ce implică mai mulţi hormoni, coordonează răspunsul metabolic al majorităţii celulelor unui organism pluricelular. Receptorii specifici pot fi intermediari în răspunsul celulelor la mesageri extracelulari (ex. hormoni, neurotransmiţători etc).
La suprafaţa celulei-ţintă sau în citoplasma ei se găseşte un receptor proteic, a cărui loc de legare demonstrează o mare afinitate pentru un mesager specific: un hormon, un feromon, sau un neurotransmiţător. Atunci când mesagerul, numit şi ligand se leagă de receptor, complexul ligand-receptor odată format declanşează o secvenţă de reacţii ce modifică funcţionarea celulei.
Răspunsul unei celule sau a unui ţesut la un grup de hormoni este efectuat în funcţie de ansamblul particular de receptori hormonali ce se găsesc la locul respectiv şi de reacţiile intracelulare provocate prin legarea unui hormon de receptorul său.
În anumite cazuri, o celulă posedă două sau mai multe tipuri de receptori pentru acelaşi ligand, fiecare tip provocând un răspuns diferit. În alte cazuri, celule distincte au ansambluri diferite de receptori pentru acelaşi hormon, fiecare receptor provocând un răspuns particular. În fine, în alte cazuri, acelaşi receptor se găseşte pe suprafaţa unor celule diferite, iar cuplarea sa cu hormonul declanşează răspunsuri diferite.
Funcţionarea unui receptor
Funcţionarea unui receptor comportă două aspecte de luat în considerare:specificitatea de legare a receptorului faţă de ligand şi specificitatea efectoare cu referire la modificarea funcţionării celulare ulterioare.
În majoritatea sistemelor ligand-receptor, ligandul pare să nu aibă altă funcţie decât cea de legare de receptor. Ligandul nu este metabolizat în produşi utilizabili, el însuşi nu este un intermediar într-o activitate celulară oarecare şi nu are proprietăţi enzimatice. Singura funcţie a ligandului ar fi modificarea proprietăţilor receptorului, fapt ce ar indica celulei prezenţa unui produs specific în mediul ei. Ligandul este deseori transformat sau degradat de către celulele-ţintă, astfel că răspunsul acestor celule sau al celulelor adiacente la mesager va fi modificat sau suprimat.
Transportul celular
Transportul prin membrana celulară
Transportul de substanțe prin membrană se realizează prin diferite mecanisme:
Transport pasiv (fără consum de energie):
- Difuzie simplă – trecerea moleculelor mici, nepolare, prin bistratul lipidic.
- Difuzie facilitată – transportul moleculelor prin proteine canal sau transportoare.
- Osmoză – difuzia apei prin membrană, reglată de concentrația solutilor.
Transport activ (cu consum de ATP):
- Pompa de sodiu-potasiu – menține diferența de potențial electric între interiorul și exteriorul celulei.
- Endocitoză și exocitoză – procese prin care celula inglobează sau elimină particule mari.
Schimbul de substanţe este posibil datorită permeabilităţii selective, însuşire fundamentală a membranei plasmice, ce face posibilă alimentarea celulei cu molecule esenţiale (glucide, aminoacizi, lipide), eliminarea unor produşi fiziologic activi (enzime, hormoni) şi a celor nocivi rezultaţi în decursul metabolismului celular (CO2, săruri de amoniu, uree).
Transportul trans-membranar în celulele procariote
Transportul de molecule în celulele bacteriene prezintă caracteristici diferite faţă de cel din celulele eucariote din două considerente:
În primul rând, în mediul intern, ce scaldă celulele speciilor superioare, concentraţia de glucoză, de acizi aminaţi şi de alţi nutrienţi este controlată în mod precis, în timp ce bacteriile sunt supuse acţiunii factorilor unor medii cu compoziţii foarte variabile. De exemplu, bacteria intestinală Escherichia coli sp. se înmulţeşte deopotrivă în sol şi în apele dulci ale lacurilor, medii cu compoziţii chimice foarte diferite.
În al doilea rând, bacteriile trebuie adesea să-şi concentreze nutrienţii (glucide, acizi aminaţi, vitamine) împotriva unor gradienţi de concentraţie chiar de 100 de ori mai ridicaţi. Este vorba de proteine de transport sau permeaze prezente în membrana celulară, a căror activitate poate fi reglată în funcţie de concentraţia moleculară disponibilă în mediul ambiant sau de necesităţile metabolice ale celulei.
Bacteriile utilizează două sisteme diferite pentru transportul moleculelor. Unul este sistemul simport, cu energia necesară absorbţiei de metaboliţi furnizată de un gradient de H+ prin membrana bacteriană. Al doilea sistem specific pentru bacterii este mecanismul de absorbţie ce necesită fosforilarea unui glucid.
Transportul trans-membranar în celulele eucariote
Membrana plasmică a celulelor eucariote având o permeabilitate selectivă deosebit de complexă poate să asigure desfăşurarea unei activităţi metabolice stabile prin menţinerea în citosol a unei concentraţii relativ constante a substanţelor organice, a metaboliţilor, a apei şi electroliţilor.
Toate aceste fenomene se petrec datorită relaţiilor stabilite între celule şi mediu, astfel că permeabilitatea selectivă se manifestă dinamic sub influenţa modificărilor din mediul extracelular şi a metabolismului propriu celulei, cu particularităţi în raport cu gradul de diferenţiere funcţională a celulelor.
Selectivitatea diferenţiată apare atât la trecerea substanţelor din exterior spre interiorul celulei, cât şi în sens invers, membrana plasmică fiind considerată o barieră a schimburilor celulare.
Traficul de substanţe are loc atât la nivelul membranei plasmice, cât şi prin endomembrane (membranele care delimitează organitele celulare). Substanţele ce traversează membranele celulare pot avea anumite greutăţi moleculare, dimensiuni, forme, grade de ionizare sau de hidratare diferite.
Unul dintre criteriile de clasificare a tipurilor de transport îl constituie dimensiunea substanţelor ce trec prin membrane . De exemplu, ionii şi moleculele mici traversează bistratul lipidic membranar prin difuzie sau cu ajutorul unor proteine membranare ( microtransport), iar macromoleculele şi unele particule mai mari trec sub formă de vezicule (macrotransport).
Un alt criteriu de clasificare se raportează la consumul de energie metabolică sub formă de ATP, necesar transportului. Din acest punct de vedere se descriu două tipuri de transport:
- transportul pasiv sau energo-independent, fără consum de energie,
- transportul activ sau energo-dependent, cu consum de energie.
Microtransportul
Microtransportul, adică transportul transmembranar de ioni şi molecule cu dimensiuni mici se poate face prin mecanismele transportului pasiv şi ale celui activ.
Transportul pasiv presupune traversarea membranelor celulare de către molecule mici şi ioni în sensul gradientului de concentraţie sau electrochimic, fără consum de ATP, dar cu pierdere de energie liberă.
Transportul activ este mediat de proteine specifice şi prezintă toate caracteristicile procesului de difuzie facilitată. În funcţie de modul în care este utilizată energia, sunt două tipuri de transport activ: transportul activ propriu- zis şi cotransportul.
În transportul activ propriu-zis, molecula transportoare are funcţie ATP- azică, fiind capabilă să utilizeze direct energia rezultată prin hidroliza ATP-ului în procesul de transport.
În cotransport, moleculele şi ionii sunt deplasaţi împotriva gradienţilor lor de concentraţie pe seama energiei eliberate în transportul pasiv al altor molecule sau ioni. În funcţie de sensul de deplasare al partenerilor de transport sunt două tipuri de cotransport: simport şi antiport. În simport, molecula sau ionul transportat se deplasează în acelaşi sens cu ionul cotransportat, iar în antiport transportul partenerilor se realizează în direcţii opuse.
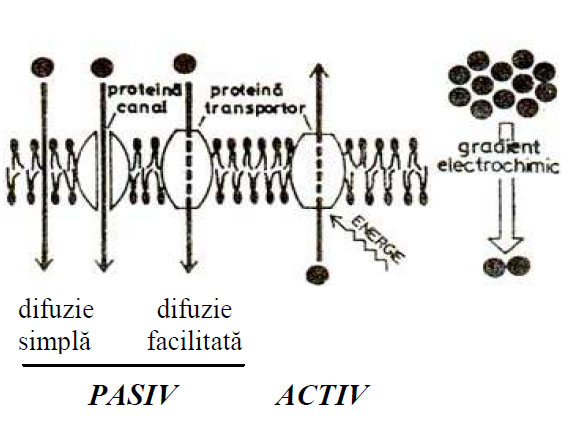
Figura 12 - Transport pasiv si activ (după Benga, 1985)
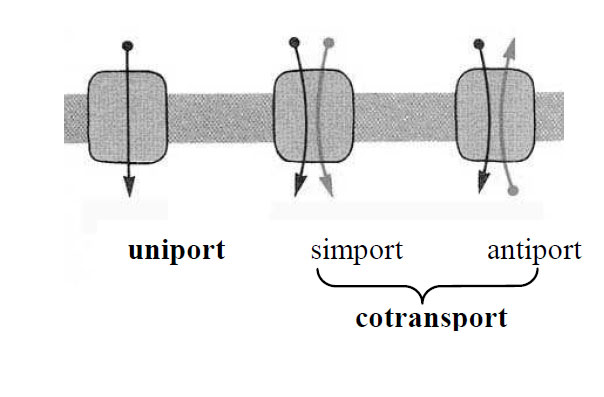
Figura 13 - Scheme de transport uniport si cotransport (după Darnell et al, 1988)
Transportul apei şi reglarea volumului celular
Moleculele de apă se deplasează prin membrana plasmică (sau printr-o barieră epitelială ca endoteliul vascular) datorită diferenţei de concentraţie a celor două soluţii separate de plasmalemă (sau de bariera epitelială) şi/sau datorită gradientului de presiune hidrostatică. Mecanismul transferului moleculelor de apă prin bistratul lipidic nu este încă elucidat, dar se sugerează posibilitatea existenţei unor proteine-canal de apă la acest nivel.
Plasarea unei celule într-un mediu hiperton sau hipoton este urmată de contracţia, respectiv destinderea spaţiului intracelular. În anumite limite, celulele sunt capabile să-şi adapteze presiunea osmotică internă şi să-şi menţină volumul relativ constant. Într-un mediu uşor hiperton, citosolul unei celule îşi micşorează valoarea pH-ului, fapt ce determină activarea sistemelor antiport Na+-H+ şi Cl--HCO . Intrarea în celulă a ionilor de Na+ şi de Cl- duce la creşterea concentraţiei saline şi a presiunii osmotice interne, ce fac posibilă intrarea moleculelor de apă în celulă şi, în unele cazuri, restabilirea volumului celular iniţial.
Transportul de medicamente dependent de ATP
Studiile oncologice şi cele efectuate pe culturi de celule selecţionate pentru rezistenţă la substanţe toxice au arătat că, în general, celulele tumorale prezintă rezistenţă la acţiunea diferitelor medicamente. Aceste observaţii au sugerat posibilitatea existenţei unei noi clase de proteine transportoare cu funcţie ATP-azică, capabile de a deplasa medica-mente împotriva gradientului lor de concentraţie pe seama energiei furnizate de ATP.
Cea mai cunoscută este glicoproteina-170 (gp 170, cu g m 170 kda), codificată de gena p-170. În celulele ce prezintă rezistenţă la mai multe medicamente, gena este puternic amplificată, rezultând o supraproducţie de proteină transportoare. Proteina gp-170 determină eliminarea din citosol în mediul extracelular a medicamentelor hidrofobe, care ajung în celulă prin difuziune. Prezenţa glicoproteinei gp-170 în celulele hepatice, renale şi epiteliale din intestin sugerează rolul ei în eliminarea metaboliţilor toxici din organism.
Transportul mediat de vezicule
Diferitele macromolecule (proteine, poliglucide, nucleotide) şi o serie de particule pot traversa plasmalema prin mecanisme de transport mediate de vezicule, de tipul: exocitozei, endocitozei,transcitozei, şi fagocitozei.
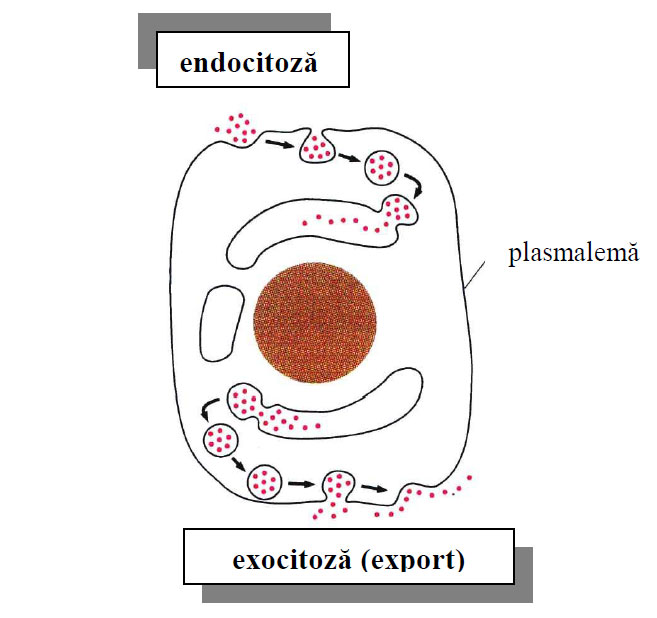
Figura 14 - Endocitoza şi exocitoza (după Alberts et al., 2010)
Exocitoza stă la baza desfăşurării unei activităţi comune majorităţii celulelor, numită secreţie celulară. Numeroasele componente ale matricei extracelulare, ale suprafeţei celulare cât şi macromolecule sub diferite forme (hormoni, enzime, neurotransmiţători, glicoproteine, proteine serice) sunt sintetizate în celulă, sunt împachetate în vezicule transportoare şi apoi sunt secretate (eliberate) prin exocitoză în mediul extracelular.
Endocitoza presupune transportul mediat de vezicule a unor macromolecule şi substanţe dizolvate în lichidul interstiţial (dintre celule) spre celulă.
Transcitoza este un tip de transport specific transcelular al diferitelor macromolecule, care se efectuează mai ales la nivelul pereţilor vaselor capilare sanguine.
Fagocitoza (phagein gr.= a mânca) este un tip de transport mediat de vezicule, prin care celulele sunt capabile să ingere diverse particule din afara lor. La organismele unicelulare, fagocitoza reprezintă principala modalitate de nutriţie, iar la mamifere şi om ea joacă un important rol în apărarea organismului.
Joncţiunile celulare
Joncţiunile celulare sunt structuri specializate, destul de stabile, ce permit sau împiedică schimburile intercelulare şi mediază contactele dintre celule sau dintre celule şi matricea extracelulară.
Joncţiunile sau sistemele jonctionale celulare au fost descrise pentru prima dată de către George Emil Palade, împreună cu Marilyn Farquhar şi Steve Wissing (1959). Ei au găsit aceste structuri în toate organele atât în stări normale cât şi patologice şi le-au atribuit denumirile latineşti folosite şi în prezent. Procesul de formare al joncţiunilor intercelulare, precum şi relaţiile lor cu moleculele adezivităţii celulare, recent identificate, sunt subiecte de mare interes în cercetarea actuală. Funcţional, se deosebesc trei categorii de joncţiuni astfel:
Joncţiunile strânse (tight junctions) închid spaţiul intercelular, jucând un rol major în determinarea permeabilităţii trans-epiteliale. Într-un epiteliu de tip „strâns ”, practic, nimic nu poate trece printre celule.
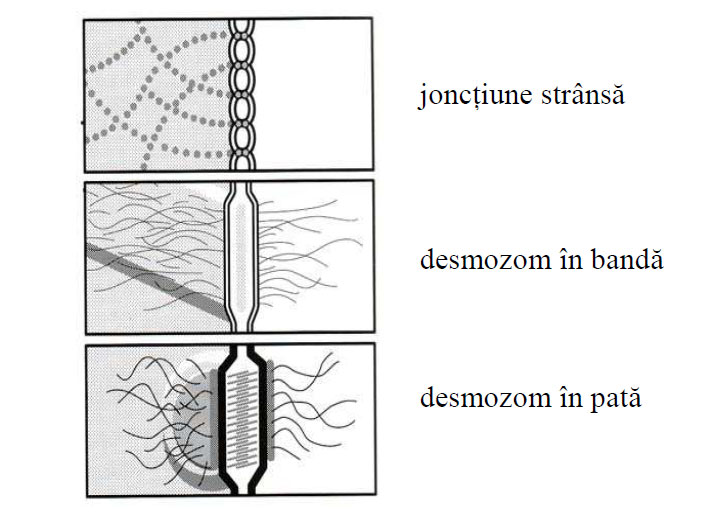
Figura 15 - Reprezentare schematică a unor joncţiuni intercelulare (după Burkitt et al, 1993)
Joncţiunile aderente sau de ancorare asigură contactul celulă-celulă sau celulă-matrice extracelulară, formează structuri de rezistenţă în ţesuturile supuse stress-ului mecanic (epitelii, miocard, miometru). Joncţiunile aderente se mai clasifică în structuri desmozomale (desmozomi şi hemidesmozomi).
Joncţiunile de comunicare (permeabile sau gap junctions) permit ionilor şi unor molecule mici să circule dintr-o celulă în alta, stabilindu-se astfel un mod de comunicare intercelulară prin mesageri chimici. În regiunea unei joncţiuni gap membranele celulelor adiacente rămân separate printr-un spaţiu extrem de îngust de numai 2 nm. Au rol este de a asigura trecerea ionilor şi a unor molecule mici (gm sub 1.000 da). Fiecare unitate funcţională, numită conexon, constă dintr-o reţea hexagonală de subunităţi proteice.
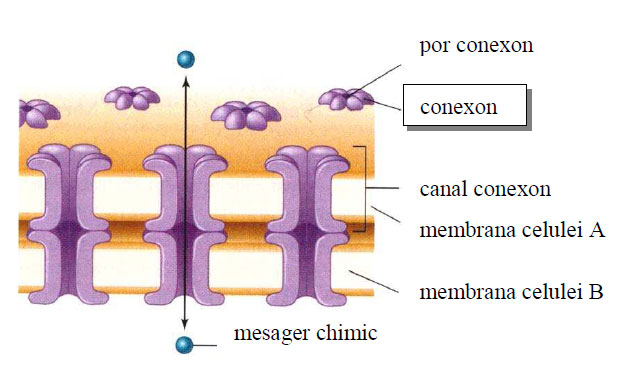
Figura 16 - Schiţa unei joncţiuni gap (după Moyes and Schulte, 2008)
Alterarea gravă a structurii celulare prin lezarea plasmalemei, moarte celulară ş.a., presupune pierderea unor cantităţi însemnate de metaboliţi celulari, concomitent cu creşterea influxului ionilor de Na+ şi Ca2+, iar concentraţia mărită a ionilor de Ca2+ determină închiderea joncţiunilor gap dintre celulele lezate şi cele normale. Prin această decuplare este asigurată funcţionarea normală a celulelor din restul ţesutului. În procesul de vindecare al leziunilor, între celule se restabilesc joncţiunile permeabile.
Plasmodesmele
În timp ce plantelor le lipsesc joncţiunile specializate aflate în ţesuturile animale, majoritatea celulelor vegetale sunt conectate unele de altele printr-o serie de canale deschise, numite plasmodesme.
Ele constau din şuviţe subţiri cilindrice de citoplasmă, ce penetrează ambele membrane plasmice ale celulelor adiacente şi peretele celular de interpunere.
Diametrul extern al plasmodesmei măsoară între 300 şi 600 A (angstromi), iar prin centrul canalului există adesea un tubul continuu, gol, cu funcţie necunoscută, numit desmotubul. Se ştie că aceste canale pot servi aceloraşi tipuri de funcţii integrative şi de comunicare atribuite joncţiunii gap prezentă între celulele animale.
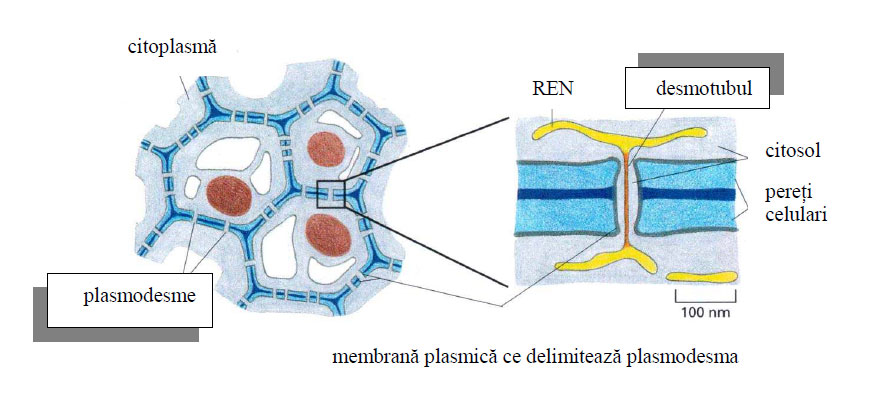
Figura 17 - Schiţa unei plasmodesme (după Alberts, 2010)
Evoluţia proprietăţilor membranei
Modificările structurii moleculare a membranei plasmice şi prin acestea, modificările anumitor proprietăţi ale celulei se petrec pe parcursul diferenţierii şi specializării ei şi apoi al îmbătrânirii şi degenerescenţei celulare.
O serie importantă de modificări au fost puse în evidenţă şi la nivelul plasmalemei celulelor canceroase. S-a observat că aceste celule, faţă de cele normale, nu mai fixează anumite substanţe (lectine) cu afinitate specifică pentru glicolemă.
Acestor modificări li s-au atribuit un defect de coeziune a celulelor canceroase, care se pot disocia cu uşurinţă pentru a da metastaze în organism. Celulele canceroase în cultură, faţă de cele normale, formează multistraturi, ceea ce demonstrează că proprietăţile lor de suprafaţă celulară sunt mult modificate.
Importanța membranei celulare
Datorită proprietăților sale, membrana celulară are un rol crucial în supraviețuirea celulei, facilitând interacțiunile cu mediul exterior și permițind adaptarea rapidă la schimbările din mediu. Studierea acestei structuri este esențială în domenii precum medicina, biologia celulară și biotehnologia.